题目内容
(1)如图是课本中“四种基本反应类型与氧化还原反应的关系”图,“H2+CuO  Cu+H2O”反应属于图中的区域 (填序号)。下列反应中属于区域7的有 。
Cu+H2O”反应属于图中的区域 (填序号)。下列反应中属于区域7的有 。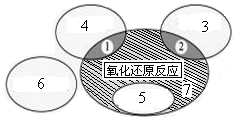
A.2H2+O2 2H2O 2H2O |
B.2NaHCO3 Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
| C.Zn+H2SO4=ZnSO4+H2↑ |
D.CuO+CO Cu+CO2 Cu+CO2 |
O2、H2CrO4、Cr(OH)3、H2O、H2O2
已知:该反应中H2O2只发生如下过程:H2O2→O2。
①该反应中,发生还原反应的物质是 。
②写出该反应的化学方程式(不用配平)
_________+________ → ________+________+________
(3)3Cl2+8NH3
 N2+6NH4Cl
N2+6NH4Cl①用双线法表示该反应转移的电子数目和方向。
②该反应中,氧化剂与还原剂分子个数之比为 。
(4)在一定条件下,PbO2与Cr3+反应,产物是Cr2O72—和Pb2+。若与1molCr3+完全反应所需PbO2的物质的量为 。
(1)5 ;D(2)①H2CrO4②H2CrO4+H2O2 → Cr(OH)3+O2 ↑+H2O
(3)①双线桥法 ②3∶2 (4)1.5mol
②3∶2 (4)1.5mol
解析试题分析:(1)化学反应的基本类型有:化合反应、分解反应、复分解反应。它们与氧化还原反应的关系是:置换反应都是氧化还原反应;复分解反应都不是氧化还原反应;有单质参加的化合反应和有单质生成的分解反应都是氧化还原反应。H2+CuO Cu+H2O是置换反应,是氧化还原反应属于图中的5。图中的7是氧化还原反应但又属于任何一种基本反应类型,对上述反应逐一分析可知为D。(2)在该反应中H2O2只发生如下过程:H2O2→O2,氧的化合价升高,失去电子,作还原剂。发生还原反应的物质是氧化剂。上述物质中只有H2CrO4 符合。它反应后生成Cr(OH)3,。所以该反应的方程式为:H2CrO4+H2O2 → Cr(OH)3+O2 ↑+H2O。(3)利用化合价升高或降低的数值就是还原剂失去或氧化剂得到电子的数值。用双线法表示该反应转移的电子数目和方向如图
Cu+H2O是置换反应,是氧化还原反应属于图中的5。图中的7是氧化还原反应但又属于任何一种基本反应类型,对上述反应逐一分析可知为D。(2)在该反应中H2O2只发生如下过程:H2O2→O2,氧的化合价升高,失去电子,作还原剂。发生还原反应的物质是氧化剂。上述物质中只有H2CrO4 符合。它反应后生成Cr(OH)3,。所以该反应的方程式为:H2CrO4+H2O2 → Cr(OH)3+O2 ↑+H2O。(3)利用化合价升高或降低的数值就是还原剂失去或氧化剂得到电子的数值。用双线法表示该反应转移的电子数目和方向如图 。在反应3Cl2+8NH3=N2+6NH4Cl中,氯的化合价0→-1,化合价降低达到电子,N化合价-3→0. 化合价升高,失去电子作还原剂,参加反应的8个分子只有2个分子失去电子,作还原剂,氧化剂与还原剂分子个数之比为3:2。(4)Cr3+→Cr6+,Pb4+→Pb2+,1molCr3+完全反应失去3mol电子,而每摩尔PbO2只能得到2mol电子,故需要PbO2的物质的量为3∕2=1。5摩尔。
。在反应3Cl2+8NH3=N2+6NH4Cl中,氯的化合价0→-1,化合价降低达到电子,N化合价-3→0. 化合价升高,失去电子作还原剂,参加反应的8个分子只有2个分子失去电子,作还原剂,氧化剂与还原剂分子个数之比为3:2。(4)Cr3+→Cr6+,Pb4+→Pb2+,1molCr3+完全反应失去3mol电子,而每摩尔PbO2只能得到2mol电子,故需要PbO2的物质的量为3∕2=1。5摩尔。
考点:考查四种基本反应类型与氧化还原反应的关系及体现氧化还原反应中的化合价的升降与电子转移、反应类型的关系的双线桥法表示等知识。

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
 2Fe(s)+3CO(g) △H=-492.7kJ/mol
2Fe(s)+3CO(g) △H=-492.7kJ/mol