题目内容
下列金属中,表面自然形成的氧化层能保护内层金属不被空气氧化的是
| A.K | B.Na | C.Fe | D.Al |
D
解析试题分析:铝在通常状况下表面形成一层致密的氧化膜,阻止内部金属被腐蚀,选D。
考点:考查金属单质的性质。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案Na2SO3在空气中易被氧化而变质。某同学为证明Na2SO3有还原性,从一瓶实验室长期存放的Na2SO3固体中取出少量溶于水,滴入一定量的烧碱溶液和少许溴水,振荡后溶液变为无色。
(1)在碱性溶液中Br2和Na2SO3反应的离子方程式 。
(2)反应后的溶液含有SO32-、SO42-、Br-、OH-等阴离子,下表是某同学鉴定其中SO32-、SO42-和Br-的实验报告,请完成未填完的部分。
限选试剂:2 mol·L-1HCl;1 mol·L-1 H2SO4;l mol·L-1BaCl2;l mol·L-1Ba(NO3)2;1 mol·L-1 KMnO4、CCl4;新制饱和氯水;品红溶液。
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 取少量待测液加入试管中,加入过量2mol·L-1HCl,再滴加适量1 mol·L-1BaCl2 溶液。 | 有白色沉淀生成,证明待测液中含有、SO42- 。 |
| 步骤② | | |
| 步骤③ | | |
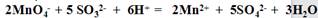
重复操作三次,每次消耗0.10mol/LKMnO4溶液体积分别为20.02 ml、 20.00 ml和19.98 ml。(相对原子质量Na 23 S 32 O 16)
①计算样品中Na2SO3的质量分数为 。(结果保留3位有效数字)
②操作时,若未用0.10mol/L的酸性KMnO4溶液润洗滴定管,会导致测定结果 。(填“偏高”、“偏低”或“没有影响”)
观察是研究物质性质的一种基本方法.一同学将一小块金属钠露置于空气中,观察到下列现象:银白色→①变灰暗→②变白色→③出现液滴→④白色固体,下列说法中正确的是 ( )
| A.①发生了氧化还原反应 | B.②变白色是因为生成了碳酸钠 |
| C.③是碳酸钠吸收空气中的水蒸气形成了溶液 | D.④只发生物理变化 |
下列物质能用铁制器皿盛放的是
| A.浓硫酸 | B.稀硫酸 | C.氯化铜溶液 | D.氯化铁溶液 |
如图所示,甲、乙、丙、丁分别代表Na2CO3、NaOH、NaHCO3、CO2四种物质,a、b、c、d、e、f分别表示两种物质间的转化关系。对于图中两种物质间的转化,通过一步反应就能实现的有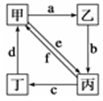
| A.只有a、b、c、d | B.只有b、c、d、e |
| C.只有c、d、e、f | D.a、b、c、d、e、f |
把一块镁铝合金投入到1 mol/L酸中,待合金完全溶解后,再往溶液里加入1 mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化的关系如下图所示,下列说法中错误的是( )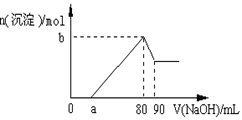
| A.盐酸的体积为80ml | B.a的取值范围为0≤ a <50 |
| C.n(Mg2+)<0.025mol | D.当a值为30时,b值为0.01 |
下列物质中,不与盐酸反应,但可与氢氧化钠溶液反应的是
| A.Al(OH)3 | B.Al2O3 | C.SiO2 | D.Al |
要使金属晶体熔化必须破坏其中的金属键。金属晶体熔、沸点高低和硬度大小一般取决于金属键的强弱。由此判断下列说法正确的是
| A.金属镁的熔点高于金属铝 |
| B.碱金属单质的熔、沸点从Li到Cs是逐渐升高的 |
| C.金属镁的硬度小于金属钙 |
| D.金属铝的硬度大于金属钠 |

 2Fe(s)+3CO(g) △H=-492.7kJ/mol
2Fe(s)+3CO(g) △H=-492.7kJ/mol