题目内容
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系,下列说法正确的是( )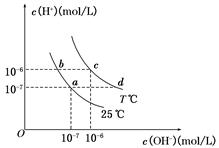
A.a点对应的溶液和c点对应的溶液pH值大小:
pH(c)>pH(a)
B.d点对应的溶液中大量存在:K+、Ba2+、NO3-、I-
C.25℃时,Ka(HF)=3.6×10-4,Ka(CH3COOH)=1.75×10-5,
0.1mol/L的NaF溶液与0.1mol/L 的CH3COOK溶液相比:
c(Na+)-c(F-)>c(K+)-c(CH3COO-)
D.如b点对应的溶液中只含NaHA,则溶液中粒子浓度大小:
c(HA-)>c(H2A)>c(H+)>c(A2-)
B
解析试题分析:A、由图可知,a点对应的是25℃时纯水的离子浓度,c(H+)=1×10-7mol/L,pH=7,c点对应的是T℃时纯水的离子浓度,c(H+)=1×10-6mol/L,pH=6,所以pH(c)<pH(a),错误;B、T℃时纯水的离子积常数是1×10-12,则d点对应的溶液中c(H+)=1×10-7mol/L<c(OH-)=1×10-5mol/L,所以溶液呈碱性,碱性条件下K+、Ba2+、NO3-、I-都不反应,可以大量共存,正确;C、根据所给酸的电离常数可知HF的酸性比醋酸的酸性强,所以等浓度的NaF溶液的水解程度比CH3COOK溶液水解程度弱,c(F-)> c(CH3COO-),c(Na+)= c(K+),则c(Na+)-c(F-)<c(K+)-c(CH3COO-),错误;D、同理可知b点对应的溶液呈酸性,说明NaHA溶液中HA-的电离程度大于其水解程度,则粒子浓度的大小关系是c(HA-)>c(H+)>c(A2-) >c(H2A),错误,答案选B。
考点:考查对图像的分析能力,水的离子积的应用,盐的水解,溶液中离子浓度的比较

部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 (25℃) | Ka=1.77×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
A. 2CN-+H2O+CO2=2HCN+CO32-
B. 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
C. 物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-) < c(K+)-c(CN-)
D. c(NH4+) 相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中,
c(NH4HCO3)>c(NH4CN) >c(HCOONH4)
下列各溶液中,微粒的物质的量浓度关系正确的是
| A.0.1 mol·L-1 Na2CO3溶液:c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3) |
| B.0.1 mol·L-1 NH4Cl溶液:c(NH4+)=c(Cl-) |
| C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+) > c(CH3COO-) > c(H+) > c(OH-) |
| D.常温下,将pH=2的盐酸和pH=12的氨水等体积混合后:c(NH4+) > c(Cl-) > c(OH-) > c(H+) |
今有室温下四种溶液,有关叙述正确的是
| | ① | ② | ③ | ④ |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
B.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
C.①、④两溶液等体积混合,所得溶液中c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D.VaL④与VbL②溶液混合后,若混合后溶液pH=4,则Va∶Vb= 9∶11
下列溶液中有关物质的浓度关系正确的是 ( )
| A.c(NH4+)相等的NH4HCO3、NH4HSO4、NH4Cl溶液中:c (NH4HSO4) ﹥c(NH4HCO3) ﹥c(NH4Cl) |
| B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:C(Na+)﹥C(CH3COO-)﹥C(H+)﹥C(OH-) |
| C.1.0mol/LNa2CO3溶液中:C(OH-)=C(HCO3-)+C (H+)+2C(H2CO3) |
| D.某二元弱酸的酸式盐NaHA溶液中:C(H+)+C(Na+)=C(OH-)+C(HA-)+C(A2-) |
常温下,对下列四种溶液的叙述正确的是
| | ① | ② | ③ | ④ |
| pH | 10 | 10 | 4 | 4 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
B.②、④两溶液相比,两者的kw相同
C.①、②、③中分别加入少量的醋酸铵固体后,三种溶液的pH均减小
D.①、④两溶液按一定体积比混合,所得溶液中离子浓度顺序一定为: c(NH4+)>c(Cl-)>c(H+)> c(OH-)
下列有关说法正确的是 ( )
| A.汽车尾气中的一氧化氮遇空气在低温下能自发进行反应,说明该反应的ΔH>0 |
| B.纯碱溶于热水中,去油污效果增强,说明纯碱的水解是放热反应 |
| C.为保护海轮的船壳,常在船壳上镶入锌块 |
| D.以熔融Al2O3为电解质进行电解冶炼铝,熔融体中Al3+向阳极移动 |
常温下,体积、物质的量浓度均相等的四种溶液:
①盐酸;②醋酸;③氨水;④CH3COONa溶液。下列说法正确的是
| A.将①与②分别稀释相同倍数后溶液的pH:①>② |
| B.若②与③混合后溶液呈中性,则在常温下Ka(CH3COOH)=Kb(NH3?H2O) |
| C.③与④中已电离的水分子的数目相等 |
| D.②与④混合所得溶液显酸性,则:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |