题目内容
常温下,取pH=2的 HA溶液与HB溶液各1 mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示。下列叙述正确的是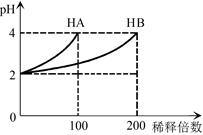
A.HB的电离方程式为HB=H++B-
B.稀释前,c(HB) > c(HA)=0.01 mol·L-1
C.NaA的水溶液中,离子浓度大小为c(Na+)>c(A-)>c(OH-)>c(H+)
D.NaA、NaB的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB)
B
解析试题分析:pH=2的两种二元酸HA与HB各1mL,分别加水稀释,由图可知,稀释100倍时HA的pH变化大,且pH=4,所以HA为强酸,HB为弱酸,则A、HB的电离方程式为HB H++B-,故A错误;B、由图可知,稀释100倍时HA的pH变化大,且pH=4,所以HA为强酸,HB为弱酸,所以c(HB)>c(HA)=0.01mol/L,故B正确;C、NaA的水溶液显中性,离子浓度大小为c(Na+)=c(A-)>c(OH-)=c(H+),故C错误;D、由于不能确定NaA、NaB的物质的量,因此二者的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB)不一定正确,故D错误,故选B。
H++B-,故A错误;B、由图可知,稀释100倍时HA的pH变化大,且pH=4,所以HA为强酸,HB为弱酸,所以c(HB)>c(HA)=0.01mol/L,故B正确;C、NaA的水溶液显中性,离子浓度大小为c(Na+)=c(A-)>c(OH-)=c(H+),故C错误;D、由于不能确定NaA、NaB的物质的量,因此二者的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB)不一定正确,故D错误,故选B。
考点:考查弱电解质的电离及离子浓度大小的比较

25℃时,几种弱酸的电离常数如下:
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
A.等物质的量浓度的各溶液pH关系为:pH(CH3COONa)> pH(Na2S) > pH(NaCN)
B.a mol/LHCN溶液与b mol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),
则a一定小于或等于b
C.NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
D.某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-dmol/L
下列实验能达到预期目的的是 ( )
| 编号 | 实验内容 | 实验目的 |
| A | 室温下,用pH试纸分别测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | 向10mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/LFeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp: Mg(OH)2 >Fe(OH)3 |
| D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 证明非金属性S>C |
下列叙述正确的是
| A.FeCl3溶液中加入镁粉有气泡产生 |
| B.C12、SO2均能使品红溶液褪色,说明二者均有漂白性 |
| C.铅蓄电池在放电过程中,负极质量减小,正极质量增加 |
| D.向饱和NaC1溶液中先通入足量CO2,再通入足量NH3,可析出NaHCO3晶体 |
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-,横坐标表示加入NaOH的体积)。根据图示判断,下列说法正确的是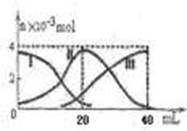
| A.当V(NaOH)=40mL时,c (Na+)+ c(H+)="2" c(A2-)+c(OH-) |
| B.当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| C.滴加过程中当溶液呈中性时,V(NaOH)<20mL |
| D.HA-的电离程度小于水解程度 |
已知在比较酸的强弱时,必须考虑两方面:一是电离出氢离子的能力,二是溶剂接受氢离子的能力。比如HCl在水中是强酸,在冰醋酸中就是弱酸;而HAc在水中是弱酸,在液氨中却是强酸,就是因为接受氢离子的能力:NH3>H2O>HAc。下列关于酸性强弱的说法正确的是( )
| A.在A溶剂中,甲的酸性大于乙;在B的溶剂中,甲的酸性可能小于乙 |
| B.比较HCl、H2SO4、HClO4、HNO3酸性的强弱,用水肯定不可以,用冰醋酸可能可以 |
| C.HNO3在HClO4中是酸,在H2SO4中可能是碱 |
| D.比较HCN与HAc酸性的强弱,用水肯定可以,用液氨肯定也可以 |
若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是( )
| A.生成了一种强酸弱碱盐 | B.弱酸溶液和强碱溶液反应 |
| C.强酸溶液和弱碱溶液反应 | D.一元强酸溶液和一元强碱溶液反应 |
常温下,关于1L pH=3的H2SO4溶液说法正确的是
| A.与等体积pH=11氨水混合后所得溶液pH小于7 |
| B.与等浓度的CH3COONa溶液混合后所得溶液pH一定小于7 |
| C.与pH=3的CH3COOH溶液混合后所得溶液pH小于3 |
| D.与10L Ba(OH)2溶液恰好完全反应,则Ba(OH)2溶液的pH一定等于10 |