题目内容
常温下,体积、物质的量浓度均相等的四种溶液:
①盐酸;②醋酸;③氨水;④CH3COONa溶液。下列说法正确的是
| A.将①与②分别稀释相同倍数后溶液的pH:①>② |
| B.若②与③混合后溶液呈中性,则在常温下Ka(CH3COOH)=Kb(NH3?H2O) |
| C.③与④中已电离的水分子的数目相等 |
| D.②与④混合所得溶液显酸性,则:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
B
解析试题分析:A、体积、物质的量浓度均相等的①与②,因盐酸完全电离,醋酸是弱酸,电离程度较小,pH:①<②,再稀释相同的倍数,仍然是①<②,故A错误;②与③混合后生成醋酸铵溶液,铵根离子和醋酸根离子均发生水解,溶液显中性,说明两者的水解能力相同,故Ka(CH3COOH)=Kb(NH3?H2O),B正确;C、氨水抑制水的电离,醋酸钠溶液中醋酸根离子水解,促进水的电离,故C错误;醋酸和醋酸钠组成的混合溶液显酸性,说明醋酸根离子的水解程度小于醋酸的电离程度,醋酸分子的浓度小于钠离子的浓度,根据电荷守恒可得c(CH3COO-)+c(OH-)=c(Na+)+c(H+),故c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),D错误;故选B。
考点:考查了强弱电解质的电离、盐水解的实质、离子浓度的比较等知识。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在0.1mol·L-1CH3COOH溶液中存在如下电离平衡: CH3COOH CH3COO-+H+,对于该平衡,下列叙述正确的是
CH3COO-+H+,对于该平衡,下列叙述正确的是
| A.加入水时,平衡向生成CH3COOH的方向移动 |
| B.加入少量NaOH固体,平衡向电离的方向移动 |
| C.加入少量0.1mol·L-1HCl溶液,溶液中c(H+)减小 |
| D.加入少量CH3COONa固体,平衡向电离的方向移动 |
现有浓度均为0.1mol/L的MgCl2溶液、氨水溶液,按体积比1:2混合。已知Mg(OH)2的Ksp=4.0×10—12,下列说法正确的是
| A.混合前,氨水溶液中c(NH4+):c(OH—)=1:1 |
| B.混合后c(NH4+):c(Cl—)=1:1 |
| C.混合后c(Mg2+)×c(OH—)= 4.0×10—12 |
| D.向混合后的分散系中加入FeCl3溶液,白色沉淀变红褐色 |
常温下,关于1L pH=3的H2SO4溶液说法正确的是
| A.与等体积pH=11氨水混合后所得溶液pH小于7 |
| B.与等浓度的CH3COONa溶液混合后所得溶液pH一定小于7 |
| C.与pH=3的CH3COOH溶液混合后所得溶液pH小于3 |
| D.与10L Ba(OH)2溶液恰好完全反应,则Ba(OH)2溶液的pH一定等于10 |
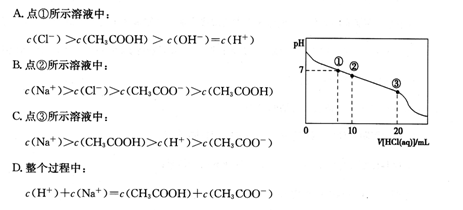
常温下,向20.00 mL 0.100 mol·L-1 CH3COONa溶液中逐滴加入0.100 0 mol·L-1盐酸,溶液的pH与所加盐酸体积的关系如下图所示(不考虑挥发)。下列说法正确的是
| A.点①所示溶液中:c(CH3COOH)=c(Cl-)>c(OH-)=c(H+) |
| B.点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH) |
| C.点③所示溶液中:c(CH3COOH)>c(Na+)>c(H+)>c(CH3COO-) |
| D.整个过程中可能出现:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-) |
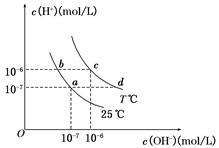
如图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是
| A.两条曲线间任意点均有c(H+)×c(OH-)=Kw |
| B.M区域内任意点均有c(H+)<c(OH-) |
| C.图中T1<T2 |
| D.XZ线上任意点均有pH=7 |