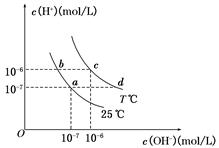
题目内容
今有室温下四种溶液,有关叙述正确的是
| | ① | ② | ③ | ④ |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
B.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
C.①、④两溶液等体积混合,所得溶液中c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D.VaL④与VbL②溶液混合后,若混合后溶液pH=4,则Va∶Vb= 9∶11
AB
解析试题分析:A、氨水为弱碱,pH=11的氨水稀释10倍,pH大于10,NaOH为强碱,pH=11的NaOH溶液稀释10倍,pH变为10,pH=3的醋酸(弱酸)稀释10倍pH大于3小于4,pH=3的HCl(强酸)稀释10倍变为4,故稀释后四种溶液的pH ①>②>④>③,正确;B、加入NH4Cl晶体,氨水的电离平衡左移,pH减小,在NaOH溶液中加入NH4Cl,铵根与氢氧根结合,使OH-浓度减小,pH减小,正确;C、①、④两溶液等体积混合因氨水为弱电解质,浓度大于盐酸,故溶液呈碱性,c(H+)<c(OH-),错误;D、VaL④与VbL②溶液混合有:Va×10-3-Vb×10-3=(Va+Vb)×10-4,则Va:Vb=11:9,错误。
考点:考查溶液的酸碱性与pH计算、离子浓度大小比较。

 名校课堂系列答案
名校课堂系列答案T ℃时,某NaOH溶液中c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T ℃),测得混合溶液的部分pH如表中所示:
| 序号 | NaOH溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 20.00 | 0.00 | 8 |
| ② | 20.00 | 20.00 | 6 |
A.3 B.4 C.5 D.6
常温下,0.2mol/L一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是
| A.HA是强酸 |
| B.该混合液pH=7 |
| C.图中x表示HA,Y表示OH-,Z表示H+ |
| D.该混合溶液中:c(A-)+c(Y)=c(Na+) |
下列实验能达到预期目的的是 ( )
| 编号 | 实验内容 | 实验目的 |
| A | 室温下,用pH试纸分别测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | 向10mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/LFeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp: Mg(OH)2 >Fe(OH)3 |
| D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 证明非金属性S>C |
25℃时,0.1mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH的关系如图所示。下列有关溶液中离子浓度关系叙述正确的是 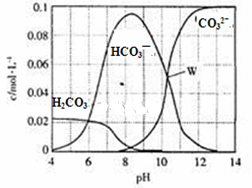
| A.W点所示的溶液中:c (Na+)+c (H+)=2c(CO32- )+c (OH-)+c (Cl-) |
| B.pH= 4的溶液中:c (H2CO3)+c (HCO3-)+c (CO32-)<0.1mol·L-1 |
| C.pH=8的溶液中:c (H+)+c (H2CO3)+c (HCO3-)= c (OH-)+c (Cl- ) |
| D.pH=11的溶液中:c (Na+)>c (Cl-)>c (CO32- )>c (HCO3- )>c (H2CO3) |
下列叙述正确的是
| A.FeCl3溶液中加入镁粉有气泡产生 |
| B.C12、SO2均能使品红溶液褪色,说明二者均有漂白性 |
| C.铅蓄电池在放电过程中,负极质量减小,正极质量增加 |
| D.向饱和NaC1溶液中先通入足量CO2,再通入足量NH3,可析出NaHCO3晶体 |
已知在比较酸的强弱时,必须考虑两方面:一是电离出氢离子的能力,二是溶剂接受氢离子的能力。比如HCl在水中是强酸,在冰醋酸中就是弱酸;而HAc在水中是弱酸,在液氨中却是强酸,就是因为接受氢离子的能力:NH3>H2O>HAc。下列关于酸性强弱的说法正确的是( )
| A.在A溶剂中,甲的酸性大于乙;在B的溶剂中,甲的酸性可能小于乙 |
| B.比较HCl、H2SO4、HClO4、HNO3酸性的强弱,用水肯定不可以,用冰醋酸可能可以 |
| C.HNO3在HClO4中是酸,在H2SO4中可能是碱 |
| D.比较HCN与HAc酸性的强弱,用水肯定可以,用液氨肯定也可以 |
在0.1mol·L-1CH3COOH溶液中存在如下电离平衡: CH3COOH CH3COO-+H+,对于该平衡,下列叙述正确的是
CH3COO-+H+,对于该平衡,下列叙述正确的是
| A.加入水时,平衡向生成CH3COOH的方向移动 |
| B.加入少量NaOH固体,平衡向电离的方向移动 |
| C.加入少量0.1mol·L-1HCl溶液,溶液中c(H+)减小 |
| D.加入少量CH3COONa固体,平衡向电离的方向移动 |