题目内容
7.向恒温、恒容(2L)的密闭容器中充入2mol SO2和一定量的O2,发生反应:2SO2(g)+O2(g)$\stackrel{一定条件}{?}$2SO3(g);△H=-197.74kJ•mol-1,4min后达到平衡,这时c(SO2)=0.2mol.•L-1,且SO2和O2的转化率相等.下列说法中正确的是( )| A. | 2min时,c(SO2)=0.6mol•L-1 | |
| B. | 再向容器中充入1mol SO3,达到新平衡,n(SO2):n(SO3)=2:1 | |
| C. | 用O2表示4min内的反应速率为0.1mol•(L•min)-1 | |
| D. | 4min后,若升高温度,平衡向逆方向移动,平衡常数K增大 |
分析 向恒温、恒容(2L)的密闭容器中充入2mol SO2和一定量的O2,4min后达到平衡,这时c(SO2)=0.2mol•L-1,平衡时SO2为2L×0.2mol•L-1=0.4mol,且SO2和O2的转化率相等,由于二者按物质的量2:1反应,故氧气起始物质的量为1mol,
2SO2(g)+O2(g)?2SO3(g)
起始量(mol):2 1 0
转化率(mol):1.6 0.8 1.6
平衡量(mol):0.4 0.2 1.6
A.4min后达到平衡,前2min速率等于后2min速率,故前2min内△c(SO2)>$\frac{1}{2}$×($\frac{2mol}{2L}$-0.2mol•L-1)=0.4mol/L;
B.原平衡时二氧化硫转化率为$\frac{1.6mol}{2mol}$=80%,再向容器中充入1mol SO3,等效为开始充入3mol SO2和一定量的1.5molO2,进一步等效为在原平衡的基础上增大压强,平衡正向移动,二氧化硫的转化率增大;
C.根据c=$\frac{△c}{△t}$计算;
D.正反应为放热反应,若升高温度,平衡向逆方向移动,平衡常数K减小.
解答 向恒温、恒容(2L)的密闭容器中充入2mol SO2和一定量的O2,4min后达到平衡,这时c(SO2)=0.2mol•L-1,平衡时SO2为2L×0.2mol•L-1=0.4mol,且SO2和O2的转化率相等,由于二者按物质的量2:1反应,故氧气起始物质的量为1mol,
2SO2(g)+O2(g)?2SO3(g)
起始量(mol):2 1 0
转化率(mol):1.6 0.8 1.6
平衡量(mol):0.4 0.2 1.6
A.4min后达到平衡,前2min速率等于后2min速率,故前2min内△c(SO2)>$\frac{1}{2}$×($\frac{2mol}{2L}$-0.2mol•L-1)=0.4mol/L,故2min时,c(SO2)<($\frac{2mol}{2L}$-0.4mol/L)=0.6mol•L-1,故A错误;
B.原平衡时二氧化硫转化率为$\frac{1.6mol}{2mol}$=80%,再向容器中充入1mol SO3,等效为开始充入3mol SO2和一定量的1.5molO2,进一步等效为在原平衡的基础上增大压强,平衡正向移动,二氧化硫的转化率增大,故新平衡时n(SO2):n(SO3)<20%:80%=1:4,故B错误;
C.用O2表示4min内的反应速率为$\frac{\frac{0.8mol}{2L}}{4min}$=0.1mol•(L•min)-1,故C正确;
D.正反应为放热反应,若升高温度,平衡向逆方向移动,平衡常数K减小,故D错误.
故选C.
点评 本题考查化学平衡计算,B选项为易错点、难点,注意利用等效思想解答,学生容易考虑利用平衡常数计算,难度中等.

| A. | $\frac{1}{9}$ | B. | $\frac{1}{6}$ | C. | $\frac{2}{9}$ | D. | $\frac{1}{3}$ |
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
| A. | 0~6 min的平均反应速率:v(H2O2)≈3.3×10-2 mol/(L•min) | |
| B. | 6~10 min的平均反应速率:v(H2O2)<3.3×10-2 mol/(L•min) | |
| C. | 反应到6 min时,H2O2分解了50% | |
| D. | 反应到6 min时,c(H2O2)=0.30 mol/L |
| A. | 原子半径:A<B | B. | 原子序数:A>B | ||
| C. | 原子最外层电子数:B>A | D. | 元素所在的周期数:A>B |
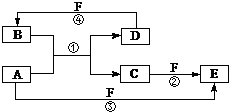 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).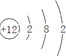 ;反应④的化学方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.
;反应④的化学方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O. ,反应①的化学方程式为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
,反应①的化学方程式为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.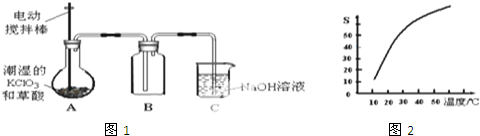
 在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t时刻达到平衡,如图所示:
在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t时刻达到平衡,如图所示: