题目内容
12.在一定温度下,10mL 0.40mol/L H2O2溶液发生催化分解,不同时刻测得生成O2的体积(已折算为标准状况)如下表.| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
| A. | 0~6 min的平均反应速率:v(H2O2)≈3.3×10-2 mol/(L•min) | |
| B. | 6~10 min的平均反应速率:v(H2O2)<3.3×10-2 mol/(L•min) | |
| C. | 反应到6 min时,H2O2分解了50% | |
| D. | 反应到6 min时,c(H2O2)=0.30 mol/L |
分析 A.0~6min产生的氧气的物质的量n(O2)=$\frac{22.4×1{0}^{-3}L}{22.4L/mol}$=0.001mol,n(H202)=2n(O2)=0.002mol,v(H202)=$\frac{\frac{0.002}{0.01}}{6}$mol/(L•min);
B.反应物浓度越大反应速率越大,随着反应进行,反应速率逐渐减小;
C.6min产生的氧气的物质的量n(O2)=$\frac{22.4×1{0}^{-3}L}{22.4L/mol}$=0.001mol,n(H202)=2n(O2)=0.002mol,其分解率=$\frac{0.002mol}{0.40mol/L×0.01L}$×100%;
D.6min时,c(H2O2)=(0.40-$\frac{0.002}{0.01}$)mol/L.
解答 解:A.0~6min产生的氧气的物质的量n(O2)=$\frac{22.4×1{0}^{-3}L}{22.4L/mol}$=0.001mol,n(H202)=2n(O2)=0.002mol,v(H202)=$\frac{\frac{0.002}{0.01}}{6}$mol/(L•min)≈3.3×10-2 mol/(L•min),故A正确;
B.反应物浓度越大反应速率越大,随着反应进行,反应速率逐渐减小,前6min内反应速率为3.3×10-2 mol/(L•min),则6~10 min的平均反应速率:v(H2O2)<3.3×10-2 mol/(L•min),故B正确;
C.6min产生的氧气的物质的量n(O2)=$\frac{22.4×1{0}^{-3}L}{22.4L/mol}$=0.001mol,n(H202)=2n(O2)=0.002mol,其分解率=$\frac{0.002mol}{0.40mol/L×0.01L}$×100%=50%,故C正确;
D.6min时,c(H2O2)=(0.40-$\frac{0.002}{0.01}$)mol/L=0.20mol/L,故D错误;
故选D.
点评 本题考查化学平衡有关计算,侧重考查学生计算能力,熟悉物质的量浓度公式、浓度与反应速率关系、转化率的计算方法等知识点即可解答,题目难度不大.

 作业辅导系列答案
作业辅导系列答案| A. | CO${\;}_{3}^{2-}$ | B. | Al3+ | C. | Cu2+ | D. | OH- |
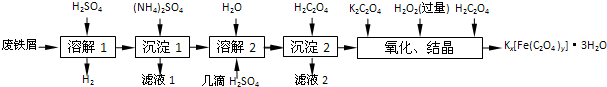
已知:(NH4)2SO4、FeSO4•7H2O、莫尔盐[(NH4)2SO4•FeSO4•6H2O]的溶解度如下表:
| 温度/℃ | 10 | 20 | 30 | 40 | 50 |
| (NH4)2SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
| FeSO4•7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | - |
| (NH4)2SO4•FeSO4•6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
(2)“复分解”制备莫尔盐晶体的基本实验步骤是:蒸发浓缩、冷却结晶、过滤、用乙醇洗涤、干燥.用乙醇洗涤的目的是洗去杂质,减少莫尔盐晶体溶解损失,便于快速干燥.
(3)“沉淀”时得到的FeC2O4•2H2O沉淀需用水洗涤干净.检验沉淀是否洗涤干净的方法是用小试管取少量最后一次洗涤液,加入BaCl2溶液,如出现白色沉淀,说明沉淀没有洗涤干净,否则,沉淀已洗涤干净.
(4)“结晶”时应将溶液放在黑暗处等待晶体的析出,这样操作的原因是黑暗可以防止晶体分解.
(5)请补全测定草酸合铁酸钾产品中Fe3+含量的实验步骤【备选试剂:KMnO4溶液、锌粉、铁粉、NaOH溶液】:
步骤1:准确称取所制备的草酸合铁酸钾晶体a g,配成250mL待测液.
步骤2:用移液管移取25.00mL待测液于锥形瓶中,加入稀H2SO4酸化,加入足量KMnO4溶液,C2O42-转化为CO2被除去.
步骤3:向步骤2所得溶液中加入稍过量的锌粉加热至充分反应(溶液黄色刚好消失),过滤、洗涤、将过滤及洗涤所得溶液收集到锥形瓶中.
步骤4:用c mol•L-1 KMnO4标准溶液滴定步骤3所得溶液至终点,消耗V mL KMnO4标准溶液.
| A. | 2min时,c(SO2)=0.6mol•L-1 | |
| B. | 再向容器中充入1mol SO3,达到新平衡,n(SO2):n(SO3)=2:1 | |
| C. | 用O2表示4min内的反应速率为0.1mol•(L•min)-1 | |
| D. | 4min后,若升高温度,平衡向逆方向移动,平衡常数K增大 |
| A. | 气体A与气体B的相对分子质量之比为m:n | |
| B. | 同质量的气体A与气体B,所含分子数目之比为n:m | |
| C. | 相同条件下,等体积的气体A与气体B的质量之比为m:n | |
| D. | 相同条件下,气体A与气体B的密度之比为n:m |
 .
.
 .
.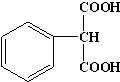 .
.