题目内容
17.元素A的阳离子与元素B的阴离子具有相同的电子层结构.以下关于A、B元素的比较中,不正确的是( )| A. | 原子半径:A<B | B. | 原子序数:A>B | ||
| C. | 原子最外层电子数:B>A | D. | 元素所在的周期数:A>B |
分析 A元素的阳离子与B元素的阴离子具有相同的电子层结构,则离子核外电子数相等,A元素处于B元素相邻的下一周期,原子序数A较大,核外电子排布相同的离子,核原子序数越大,离子半径越小,所以B离子半径较大.
解答 解:A元素的阳离子与B元素的阴离子具有相同的电子层结构,则离子核外电子数相等,A元素处于B元素相邻的下一周期.
A.A元素形成阳离子与B元素形成阴离子,A元素处于B元素相邻的下一周期,电子层越多,原子半径越大原子半径A>B,故A错误;
B.A元素的阳离子与B元素的阴离子具有相同的电子层结构,则离子核外电子数相等,A元素处于B元素相邻的下一周期,原子序数A较大,即原子序数A>B,故B正确;
C.A元素易形成阳离子,则A原子的最外层电子数小于4,B元素易形成阴离子,则B原子的最外层电子数大于4,所以原子最外层电子数:B>A,故C正确;
D.A元素的阳离子与B元素的阴离子具有相同的电子层结构,则离子核外电子数相等,A元素处于B元素相邻的下一周期,则元素所在的周期数:A>B,故D正确;
故选:A.
点评 本题考查结构与位置关系,难度中等,关键根据离子的电子层结构推断元素的位置关系.

练习册系列答案
相关题目
7.向恒温、恒容(2L)的密闭容器中充入2mol SO2和一定量的O2,发生反应:2SO2(g)+O2(g)$\stackrel{一定条件}{?}$2SO3(g);△H=-197.74kJ•mol-1,4min后达到平衡,这时c(SO2)=0.2mol.•L-1,且SO2和O2的转化率相等.下列说法中正确的是( )
| A. | 2min时,c(SO2)=0.6mol•L-1 | |
| B. | 再向容器中充入1mol SO3,达到新平衡,n(SO2):n(SO3)=2:1 | |
| C. | 用O2表示4min内的反应速率为0.1mol•(L•min)-1 | |
| D. | 4min后,若升高温度,平衡向逆方向移动,平衡常数K增大 |
12.下列选项与胶体知识无关的是( )
| A. | 在豆浆里加入盐卤做豆腐 | |
| B. | 水泥、冶金厂常用高压电除去工厂烟尘,以减少对空气污染 | |
| C. | 一束平行光线照射暗箱中的蛋白质溶液时,从侧面可以看到光亮的通路 | |
| D. | 氯化铝溶液中加入小苏打溶液会产生白色沉淀和气体 |
2.同温同压下,m g气体A与n g气体B的分子数目相同,下列说法中不正确的是( )
| A. | 气体A与气体B的相对分子质量之比为m:n | |
| B. | 同质量的气体A与气体B,所含分子数目之比为n:m | |
| C. | 相同条件下,等体积的气体A与气体B的质量之比为m:n | |
| D. | 相同条件下,气体A与气体B的密度之比为n:m |
9.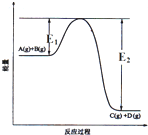 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,正确的是( )
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,正确的是( )
 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,正确的是( )
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,正确的是( )| A. | 该反应是吸热反应 | |
| B. | 当反应达到平衡时,升高温度,A的转化率增大 | |
| C. | 反应体系中加入催化剂对反应热没有影响 | |
| D. | 在反应体系中加催化剂,反应速率增大,E1、E2均减小 |
7.依据:2Fe2++Cl2═2Fe3++2Cl-、2Fe3++Cu═2Fe2++Cu2+、Fe+Cu2+═Fe2++Cu,判断氧化性强弱顺序正确的是( )
| A. | Fe3+>Cl2>Fe2+>Cu2+ | B. | Cl2>Fe3+>Cu2+>Fe2+ | ||
| C. | Cl2>Fe3+>Fe2+>Cu2+ | D. | Fe3+>Cl2>Cu2+>Fe2+ |