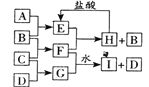
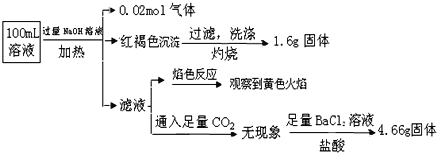
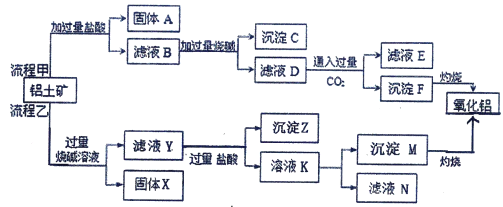
题目内容
【题目】电解Na2PbCl4溶液,生成Pb,装置如下图,下列说法不正确的是
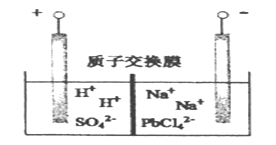
A. 阴极的电极反应式为 PbCl42- +2e- =Pb + 4Cl-
B. 电解一段时间后,Na2PbCl4浓度极大下降,可加入PbO恢复其浓度
C. 电解过程中阳极溶液的pH减小,阴极的pH保持不变
D. 电路中通过0.2mol,则阴极的质量增加20.7g
【答案】C
【解析】A. 阴极的电极反应式为PbCl42- +2e-=Pb+4Cl-,故A正确;B. 电解反应为2PbCl42-+2H2O![]() O2↑+2Pb+4 H++8Cl-,电解一段时间后,Na2PbCl4浓度极大下降,溶液减少的成分是O2↑和Pb相当于PbO,可加入PbO恢复其浓度,故B正确;C. 电解过程中阳极反应:2H2O-4e-
O2↑+2Pb+4 H++8Cl-,电解一段时间后,Na2PbCl4浓度极大下降,溶液减少的成分是O2↑和Pb相当于PbO,可加入PbO恢复其浓度,故B正确;C. 电解过程中阳极反应:2H2O-4e-![]() O2↑+4H+,同时H+由左向右通过质子交换膜,所以阳极溶液的pH不变,阴极溶液的pH减小,故C不正确;D. Pb~2e-,电路中通过0.2mol e-,则阴极增加0.1molPb,阴极的质量增加20.7g,故D正确。故选C。
O2↑+4H+,同时H+由左向右通过质子交换膜,所以阳极溶液的pH不变,阴极溶液的pH减小,故C不正确;D. Pb~2e-,电路中通过0.2mol e-,则阴极增加0.1molPb,阴极的质量增加20.7g,故D正确。故选C。

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案【题目】X、Y、Z、Q、R是五种短周期元素,原子序数依次增大,部分元素在周期表中的位置关系如右图所示.其中X是周期表中原子半径最小的元素,Q与X同主族;Z的最外层电子数是次外层的3倍.
Y | Z | ||
R |
请回答下列问题:
(1)写出Y元素的名称:________,Q的原子结构示意图________;R在周期表中的位置为________.
(2)Q2Z电子式为:________,Q2Z2含的化学键类型为:________.
(3)R、Z分别形成简单离子的半径大小:________________(离子符号表示)
(4)Y的氢化物与其最高价氧化物对应的水化物反应的化学方程式为:__________________________.