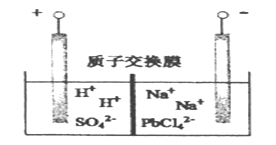
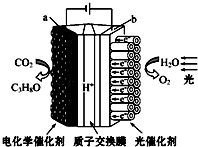
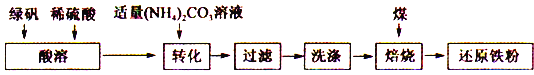
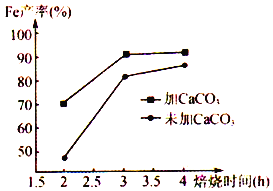
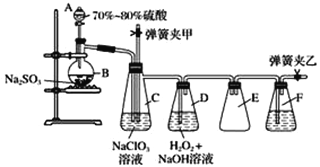
题目内容
【题目】X、Y、Z、Q、R是五种短周期元素,原子序数依次增大,部分元素在周期表中的位置关系如右图所示.其中X是周期表中原子半径最小的元素,Q与X同主族;Z的最外层电子数是次外层的3倍.
Y | Z | ||
R |
请回答下列问题:
(1)写出Y元素的名称:________,Q的原子结构示意图________;R在周期表中的位置为________.
(2)Q2Z电子式为:________,Q2Z2含的化学键类型为:________.
(3)R、Z分别形成简单离子的半径大小:________________(离子符号表示)
(4)Y的氢化物与其最高价氧化物对应的水化物反应的化学方程式为:__________________________.
【答案】 氮 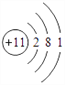 第三周期ⅢA族
第三周期ⅢA族 ![]() 离子键、共价键 Al3+<O2﹣ NH3+HNO3═NH4NO3
离子键、共价键 Al3+<O2﹣ NH3+HNO3═NH4NO3
【解析】X是周期表中原子半径最小的元素,则X为H元素,Z的最外层电子数是次外层的3倍,则Z为O元素,所以Y为N元素,故R为Al元素,Q与X同主族, Q的原子序数小于Al的原子序数大于O的原子序数,所以Q为Na。
(1)根据上面分析知Y的名称为:氮;Na的原子结构示意图为: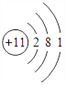 ;Al在周期表中的位置为:第三周期ⅢA族。
;Al在周期表中的位置为:第三周期ⅢA族。
(2)Na2O的电子式为:![]() ;Na2O2为离子化合物,阳离子为Na+,阴离子为O22-,故含有的化学键为离子键和共价键。
;Na2O2为离子化合物,阳离子为Na+,阴离子为O22-,故含有的化学键为离子键和共价键。
(3)Al3+、O2-的电子层结构相同,根据“序大径小”的规律可知离子半径大小关系为:Al3+<O2﹣。
(4)N的氢化物为NH3,N的最高价氧化物的水合物为HNO3,两者反应的化学方程式为:NH3+HNO3═NH4NO3。

练习册系列答案
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目