题目内容
【题目】A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E,B与G,D与H分别为同一主族,C和D的最外层电子数之和为11,C、D、F三种元素的原子序数之和为28。请回答下列问题:
(1)B与D可形成共价化合物X,过量的X与F D2-溶液反应的离子方程式为____________________________
(2)E、F、H所形成的简单离子的半径由大到小的顺序为(用离子符号表示)_________。
(3)G的最高价氧化物与B的单质在高温下能发生置换反应,其化学反应方程式为:
____________________________________________________。
(4)盐Y由B、D、E组成。以熔融盐Y为电解质构成的氢氧燃料电池。写出石墨负极上发生的电极反应式:________________________________。
(5)1g液态A4BD燃烧通常情况下放出13.86KJ热量,写出此物质燃烧热的热化学方程式:_________________________________________________________________
(6)在一个装有可移动活塞的容器中进行如下反应:C2(g)+3A2(g)![]() 2CA3(g),反应达到平衡后,测得容器中含有C2 0.5mol,A20.2mol,CA30.2mol,总容积为1.0L。
2CA3(g),反应达到平衡后,测得容器中含有C2 0.5mol,A20.2mol,CA30.2mol,总容积为1.0L。
①如果达成此平衡前各物质起始的量有以下几种可能,其中不合理的是________:
A.C2 0.6mol, A2 0.5mol, CA30mol
B.C2 0mol, A2 0mol, CA3 1.2mol
C.C2 0.6mol/L,A2 0.5mol/L, CA3 0.1mol/L
②求算此平衡体系的平衡常数K=________;
【答案】 AlO2-+ CO2 +2H2O=Al(OH)3↓+HCO3- S2->Na+>Al3+ SiO2+2C ![]() Si+2CO↑ H2+CO32--2e-=H2O+CO2 CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l); △H=-443.52kJ/mol BC 10
Si+2CO↑ H2+CO32--2e-=H2O+CO2 CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l); △H=-443.52kJ/mol BC 10
【解析】A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,则A为氢元素;A与E同一主族,E原子序数比A至少大4,可推知E为Na;B、C、D为同一周期,应处于第二周期,E、F、G、H都处于第三周期,C和D的最外层电子数之和为11,则二者核外电子数之和为2+2+11=15,C、D、F三种元素的原子序数之和为28,则F的原子序数=28-15=13,故F为Al元素;B与G,G的原子序数大于Al,则二者族序数大于Ⅲ,D与H为同一主族,又C、D原子序数之和为15,可推知B为碳元素、C为N元素、D为O元素、G为Si、H为S元素。
(1)B与D可形成非极性分子X为CO2,过量的X(CO2)与FD2-(AlO2-)溶液反应的离子方程式为:AlO2-+ CO2 +2H2O=Al(OH)3↓+HCO3-;(2)电子层结构相同的离子,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2->Na+>Al3+;(3)G的最高价氧化物为SiO2,与B的单质(碳)在高温下能发生置换反应,其化学反应方程式为:SiO2+2C ![]() Si+2CO↑;(4)盐Y由C、O、Na组成,则Y为Na2CO3,以熔融盐Na2CO3为电解质、氢气、氧气构成的燃料电池,由图可知石墨(I)是氢气失去电子,与碳酸结合生成水与二氧化碳,电极反应式:H2+CO32--2e-=H2O+CO2;(5)1g液态A4BD(为CH3OH)燃烧通常情况下放出13.86KJ热量,则1molCH3OH燃烧放出的热量为443.52kJ,此物质燃烧热的热化学方程式为:CH3OH(l)+
Si+2CO↑;(4)盐Y由C、O、Na组成,则Y为Na2CO3,以熔融盐Na2CO3为电解质、氢气、氧气构成的燃料电池,由图可知石墨(I)是氢气失去电子,与碳酸结合生成水与二氧化碳,电极反应式:H2+CO32--2e-=H2O+CO2;(5)1g液态A4BD(为CH3OH)燃烧通常情况下放出13.86KJ热量,则1molCH3OH燃烧放出的热量为443.52kJ,此物质燃烧热的热化学方程式为:CH3OH(l)+ ![]() O2(g)=CO2(g)+2H2O(l); △H=-443.52kJ/mol;(4)①A.当N2反应0.1mol时,H2反应0.3mol,生成NH3 0.2mol,符合转化关系,选项A正确;B.NH3反应1mol,应生成H2 1.5mol,与平衡状态不同,选项B错误;C.当N2反应0.1mol时,H2反应0.3mol,生成NH3 0.2mol,加上原有NH3 0.2mol,平衡时NH3应为0.4mol,与平衡状态不同,选项C错误;答案选BC;②K═
O2(g)=CO2(g)+2H2O(l); △H=-443.52kJ/mol;(4)①A.当N2反应0.1mol时,H2反应0.3mol,生成NH3 0.2mol,符合转化关系,选项A正确;B.NH3反应1mol,应生成H2 1.5mol,与平衡状态不同,选项B错误;C.当N2反应0.1mol时,H2反应0.3mol,生成NH3 0.2mol,加上原有NH3 0.2mol,平衡时NH3应为0.4mol,与平衡状态不同,选项C错误;答案选BC;②K═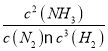 =
=![]() =10。
=10。

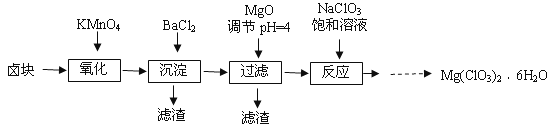
【题目】聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4,少量C及SiO2)为原料制备的流程如下:
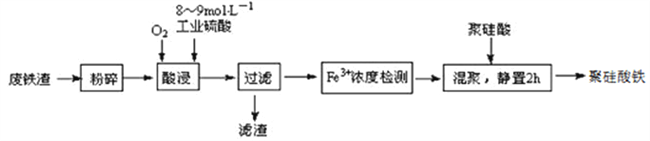
已知:在一定温度下酸浸时Fe3+在pH=2开始沉淀,pH=3.7沉淀完全
(1)废铁渣进行“粉碎”的目的是___________________________________________________。
(2)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等,其中酸浸温度对铁浸取率的影响如下表所示:
温度℃ | 40 | 60 | 80 | 100 | 120 |
铁浸取率 | 50 | 62 | 80 | 95 | 85 |
①请写出酸浸过程中Fe3O4发生的离子反应方程式__________________________________。
②硫酸酸浸时应控制溶液的pH____________,其原因是_________________________________。
③当酸浸温度超过100℃时,铁浸取率反而减小,其原因是___________________。
(3)上述过滤步骤的滤液的主要成分为____________(填化学式)。
(4)Fe3+浓度定量检则,是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),该滴定反应的离子方程式为____________。