题目内容
7.可以认为麦芽糖分子是2个葡萄糖分子经分子间脱水反应而形成的.若按此理解10个葡萄糖分子形成链状化合物的化学式应为( )| A. | C60H120O60 | B. | C60H100O52 | C. | C60H102O51 | D. | C60H112O51 |
分析 葡萄糖分子连接起来形成的链状化合物时,相邻的2个分子间脱去一分子的水,据此解题.
解答 解:10个C6H12O6分子间脱去9个水分子生成链状化合物,故链状化合物的分子式应为:10C6H12O6-9H2O→C60H102O51.
故选C.
点评 本题考查葡萄糖的性质,题目难度不大,注意掌握葡萄糖形成链状化合物的原理.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.高温下,某反应达到平衡,平衡常数K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.恒容时,温度升高,H2浓度减小.下列说法不正确的是( )
| A. | 该反应是焓变为正值 | |
| B. | 恒温恒容下,充入更多的CO2,能提高H2的转化率 | |
| C. | 升高温度,正、逆反应速率均增大 | |
| D. | 该反应化学方程式为:CO+H2O$?_{△}^{催化剂}$ CO2+H2 |
18.下列说法正确的是( )
| A. | 增大压强,活化分子数增多,化学反应速率一定增大 | |
| B. | 升高温度,活化分子百分数不一定增大,化学反应速率一定增大 | |
| C. | 加入反应物,使活化分子百分数增加,化学反应速率增大 | |
| D. | 使用催化剂,降低了反应的活化能,增大了活化分子百分数,化学反应速率一定增大 |
15.下列过程的离子方程式正确的是( )
| A. | 氨水与醋酸的反应:NH3•H2O+CH3COOH=CH3COO-+NH4 ++H2O | |
| B. | 大理石与盐酸溶液反应:CaCO3+2H+=Ca2++CO2↑+H2O | |
| C. | H2SO4溶液中滴加Ba(OH)2溶液至不再产生沉淀:H++SO42-+OH-+Ba2+=BaSO4↓+H2O | |
| D. | 铁屑溶于稀盐酸中:2Fe+6H+=2Fe3++3H2↑ |
2.甲、乙、丙均为中学化学常见气体单质,A、B、C为常见的化合物.可供参考的信息有:

(I)A和B都极易溶于水,用两根玻璃棒分别蘸A和B的浓溶液后相互靠近,会看到白烟.
(II)甲与乙在一定条件下反应的有关数据为:
分析上述信息回答下列问题:
(1)丙的电子式为:
(2)甲与乙反应生成A的速率为:v(甲)=0.6mol/(L•s).
(3)写出C与NaOH溶液反应生成A的离子方程式NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑.

(I)A和B都极易溶于水,用两根玻璃棒分别蘸A和B的浓溶液后相互靠近,会看到白烟.
(II)甲与乙在一定条件下反应的有关数据为:
| 项目 | 甲 | 乙 | A |
| 起始时 | 3mol/L | 3mol/L | 0 |
| 2s末 | 1.8mol/L | 2.6mol/L | 0.8mol/L |
(1)丙的电子式为:

(2)甲与乙反应生成A的速率为:v(甲)=0.6mol/(L•s).
(3)写出C与NaOH溶液反应生成A的离子方程式NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑.
12.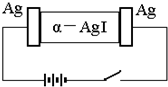 α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关结论正确的是( )
α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关结论正确的是( )
 α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关结论正确的是( )
α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关结论正确的是( )| A. | 若α-AgI是Ag+导电则通电一段时间后晶体密度不均匀 | |
| B. | 若α-AgI是Ag+导电则通电一段时间后晶体密度可能均匀 | |
| C. | 若α-AgI是I-导电则通电一段时间后晶体密度不均匀 | |
| D. | 若α-AgI是I-导电则通电一段时间后晶体密度仍均匀 |
4.某化学反应2A (g)≒B(g)+D(g) 在4种不同条件下进行,B和D的起始浓度为0,反应物A 的浓度(mol•L-1) 随反应时间 (min) 的变化情况如表:
根据上述数据,完成下列填空:
(1)实验1中,在10~20min时间内,以A的速率表示的平均反应速率为0.013mol•L-1•min-1,反应经40min就达到平衡.
(2)实验2中,A的初始浓度c2=1.0mol•L-1,反应经20min就达到平衡.
(3)实验4比实验1的反应速率快(填“快”或“慢”),原因是反应达到平衡所需时间短.
| 实验 序号 |  | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)实验1中,在10~20min时间内,以A的速率表示的平均反应速率为0.013mol•L-1•min-1,反应经40min就达到平衡.
(2)实验2中,A的初始浓度c2=1.0mol•L-1,反应经20min就达到平衡.
(3)实验4比实验1的反应速率快(填“快”或“慢”),原因是反应达到平衡所需时间短.