题目内容
4.某化学反应2A (g)≒B(g)+D(g) 在4种不同条件下进行,B和D的起始浓度为0,反应物A 的浓度(mol•L-1) 随反应时间 (min) 的变化情况如表:| 实验 序号 |  | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)实验1中,在10~20min时间内,以A的速率表示的平均反应速率为0.013mol•L-1•min-1,反应经40min就达到平衡.
(2)实验2中,A的初始浓度c2=1.0mol•L-1,反应经20min就达到平衡.
(3)实验4比实验1的反应速率快(填“快”或“慢”),原因是反应达到平衡所需时间短.
分析 (1)根据V=$\frac{△c}{△t}$计算反应速率;化学反应达到化学平衡状态时,各物质的浓度不再发生变化;
(2)达到平衡的标志是浓度不再改变,催化剂呢过加快反应速率;化学反应达到化学平衡状态时,各物质的浓度不再发生变化;
(3)根据反应达到平衡所需的时间长短进行判断
解答 解:(1)在实验1中,反应在10至20min时间内A的平均速率为V=$\frac{△c}{△t}$=$\frac{0.80mol/L-0.67mol/L}{10min}$=0.013mol•(L•min)-1;实验1,40分钟时,A的浓度不再发生变化,故达到平衡的时间是40分钟;故答案为:0.013;40分钟;
(2)实验2中,反应经20minA的浓度不再改变,说明达到平衡,较其他实验达到平衡时间最短,故使用了合适的催化剂,起始浓度c2=1.0mol/L;
故答案为:1.0;20;
(3)实验4与实验1比,实验4达到平衡所需时间短,故实验4的反应速率快于实验1,
故答案为:快;反应达到平衡所需时间短;
点评 本题考查反应速率的表示方法,化学平衡移动的判断,掌握反应速率的计算方法是解题的关键,题目难度中等.

练习册系列答案
相关题目
6.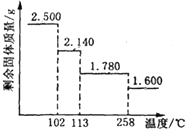 胆矾晶体(CuSO4•5H2O)中4个水分子与铜离子形成配位键,另一个水分子只以氢键与相邻微粒结合.某兴趣小组称取2.500g胆矾晶体,逐渐升温使其失水,并准确测定不同温度下剩余固体的质量,得到如图所示的实验结果示意图.以下说法正确的是 ( )
胆矾晶体(CuSO4•5H2O)中4个水分子与铜离子形成配位键,另一个水分子只以氢键与相邻微粒结合.某兴趣小组称取2.500g胆矾晶体,逐渐升温使其失水,并准确测定不同温度下剩余固体的质量,得到如图所示的实验结果示意图.以下说法正确的是 ( )
 胆矾晶体(CuSO4•5H2O)中4个水分子与铜离子形成配位键,另一个水分子只以氢键与相邻微粒结合.某兴趣小组称取2.500g胆矾晶体,逐渐升温使其失水,并准确测定不同温度下剩余固体的质量,得到如图所示的实验结果示意图.以下说法正确的是 ( )
胆矾晶体(CuSO4•5H2O)中4个水分子与铜离子形成配位键,另一个水分子只以氢键与相邻微粒结合.某兴趣小组称取2.500g胆矾晶体,逐渐升温使其失水,并准确测定不同温度下剩余固体的质量,得到如图所示的实验结果示意图.以下说法正确的是 ( )| A. | 晶体从常温升至105℃的过程中只有氢键断裂 | |
| B. | 受热过程中,胆矾晶体中形成配位键的4个水分子同时失去 | |
| C. | 120℃时,剩余固体的化学式是CuSO4•H2O | |
| D. | 按胆矾晶体失水时所克服的作用力大小不同,晶体中的水分子所处化学环境可以分为3种 |
7.可以认为麦芽糖分子是2个葡萄糖分子经分子间脱水反应而形成的.若按此理解10个葡萄糖分子形成链状化合物的化学式应为( )
| A. | C60H120O60 | B. | C60H100O52 | C. | C60H102O51 | D. | C60H112O51 |
11.有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯化铝锂(LiAlCl4)溶解在亚硫酰氯(SOCl2)中形成的,电池的总反应方程式为:8Li+3SOCl2═6LiCl+Li2SO3+2S,下列叙述中错误的是( )
| A. | 金属锂作电池的负极,石墨作电池的正极 | |
| B. | 电解质溶液中不能混入水,必须与空气隔绝 | |
| C. | 电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3 | |
| D. | 电池工作过程中,金属锂提供的电子与正极区析出的硫物质的量之比为4:1 |
16.在元素周期表中第三周期所含元素的种数为( )
| A. | 2 | B. | 8 | C. | 18 | D. | 32 |


 .
.
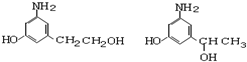 .
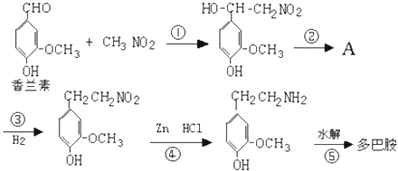
.
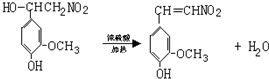 .
.