题目内容
2.甲、乙、丙均为中学化学常见气体单质,A、B、C为常见的化合物.可供参考的信息有:
(I)A和B都极易溶于水,用两根玻璃棒分别蘸A和B的浓溶液后相互靠近,会看到白烟.
(II)甲与乙在一定条件下反应的有关数据为:
| 项目 | 甲 | 乙 | A |
| 起始时 | 3mol/L | 3mol/L | 0 |
| 2s末 | 1.8mol/L | 2.6mol/L | 0.8mol/L |
(1)丙的电子式为:

(2)甲与乙反应生成A的速率为:v(甲)=0.6mol/(L•s).
(3)写出C与NaOH溶液反应生成A的离子方程式NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑.
分析 A和B都极易溶于水,用两根玻璃棒分别蘸A和B的浓溶液后相互靠近,会看到白烟,应生成氯化铵,可知甲为氢气,由转化关系可知A为NH3,B为HCl,则乙为N2,丙为Cl2,生成白色沉淀为AgCl,以此解答该题.
解答 解:A和B都极易溶于水,用两根玻璃棒分别蘸A和B的浓溶液后相互靠近,会看到白烟,应生成氯化铵,可知甲为氢气,由转化关系可知A为NH3,B为HCl,则乙为N2,丙为Cl2,生成白色沉淀为AgCl,
(1)由以上分析可知丙为Cl2,电子式为 ,故答案为:
,故答案为: ;
;
(2)2s末时甲的浓度变化值为1.2mol/L,则v=$\frac{1.2mol/L}{2s}$=0.6 mol/(L•s),故答案为:0.6 mol/(L•s);
(3)氯化铵与氢氧化钠反应生成氯化钠和氨气,反应的离子方程式为NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑,故答案为:NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑.
点评 本题考查无机物的推断,为高考常见题型和高频考点,侧重于学生的分析能力的考查,题目难度不大,注意根据转化关系判断物质反应的类型,结合物质的特点进行解答,注意相关基础知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.已知Ksp(Mg(OH)2)=1.8×10-11,则Mg(OH)2在pH=12.00的NaOH溶液中Mg2+浓度为( )
| A. | 1.8×10-7mol•L-1 | B. | 1.0×10-5 mol•L-1 | ||
| C. | 1.0×10-7 mol•L-1 | D. | 1.8×10-9 mol•L-1 |
10.能证明乙醇分子中存在羟基的事实是( )
| A. | 乙醇燃烧有CO2和H2O | B. | 乙醇能够和金属钠反应生成氢气 | ||
| C. | 乙醇能溶于水 | D. | 乙醇能燃烧 |
17.下表中关于物质分类的正确组合是( )
| 类别组合 | 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 |
| A | CO | CuO | H2SO4 | NH3•H2O | Na2S |
| B | CO2 | Na2O | HCl | NaOH | NaCl |
| C | SO2 | Na2O2 | CH3COOH | KOH | CaF2 |
| D | NO2 | CaO | HNO3 | Cu(OH)2CO3 | CaCO3 |
| A. | A | B. | B | C. | C |
7.可以认为麦芽糖分子是2个葡萄糖分子经分子间脱水反应而形成的.若按此理解10个葡萄糖分子形成链状化合物的化学式应为( )
| A. | C60H120O60 | B. | C60H100O52 | C. | C60H102O51 | D. | C60H112O51 |
14.下列两种气体的分子数一定相等的是( )
| A. | 等温等体积的O2和N2 | B. | 等压等体积的N2和CO2 | ||
| C. | 质量相等、密度不等的N2和C2H4 | D. | 体积相等、密度不等的CO和C2H4 |
11.有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯化铝锂(LiAlCl4)溶解在亚硫酰氯(SOCl2)中形成的,电池的总反应方程式为:8Li+3SOCl2═6LiCl+Li2SO3+2S,下列叙述中错误的是( )
| A. | 金属锂作电池的负极,石墨作电池的正极 | |
| B. | 电解质溶液中不能混入水,必须与空气隔绝 | |
| C. | 电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3 | |
| D. | 电池工作过程中,金属锂提供的电子与正极区析出的硫物质的量之比为4:1 |
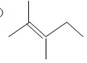
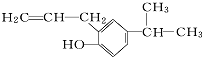 的分子式为C12H16O.
的分子式为C12H16O. 分子中至少有11个碳原子处于同一平面上.
分子中至少有11个碳原子处于同一平面上.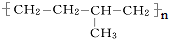 的单体为
的单体为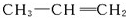 和
和 .
.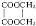 +2H2O,反应类型是酯化反应.
+2H2O,反应类型是酯化反应.