题目内容
【题目】25℃时,浓度均为0.1mol/L的溶液,其pH如下表所示。有关说法正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | CH3COONa |
pH | 7.0 | 7.0 | 8.1 | 8.9 |
A.酸性强弱:CH3COOH>HF
B.离子的总浓度:①>③
C.②中:c(CH3COO-)=c(NH4+)=c(OH-)=c(H+)
D.②和④中c(CH3COO-)相等
【答案】B
【解析】
A.NaF和CH3COONa溶液中阴离子水解显碱性,对应酸性越弱,阴离子水解程度越强;
B.氯化钠溶液是强酸强碱溶液不水解,溶液中氢离子浓度等于氢氧根离子浓度,NaF溶液中氟离子水解破坏了水的电离,溶液中氢氧根离子浓度大于氢离子浓度,结合溶液中电荷守恒比较大小;
C.醋酸根离子和铵根离子水解程度相同,溶液显中性,电解质的浓度远大于氢离子和氢氧根离子的浓度;
D.CH3COONH4与CH3COONa的水解程度不同。
A.由表中数据得到,碱性:NaF<CH3COONa,所以说明阴离子的水解能力:F-<CH3COO-,根据越弱越水解的原理,得到酸性:CH3COOH<HF,选项A错误;
B.①③两种溶液有各自的电荷守恒式:c(Na+)+c(H+)=c(Cl-)+c(OH-);c(Na+)+c(H+)=c(F-)+c(OH-),所以两种溶液的离子总浓度都等于各自的2[c(Na+)+c(H+)],因为两种溶液中的钠离子浓度相等,所以只需要比较两种溶液的氢离子浓度即可;pH为:①<③,所以①的氢离子浓度更大,即溶液①的2[c(Na+)+c(H+)]大于溶液③的2[c(Na+)+c(H+)],所以离子的总浓度:①>③,选项B正确;
C.溶液②中,pH=7,所以c(H+)=c(OH-)=1×10-7 mol/L,明显溶液中的醋酸根和铵根离子的浓度都接近0.1 mol/L(电离和水解的程度都不会太大),所以应该是c(CH3COO-)=c(NH![]() )>c(OH-)=c(H+),选项C错误;
)>c(OH-)=c(H+),选项C错误;
D.醋酸铵中,铵根离子对于醋酸根离子的水解起到促进作用,醋酸钠中钠离子对于醋酸根离子的水解应该无影响,所以醋酸根离子浓度是②<④,选项D错误;
故选B。

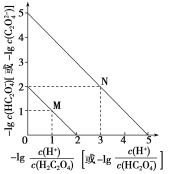
【题目】滴定法是解决化学分析问题的常用方法。滴定的方法有酸碱中和滴定、氧化还原滴定、沉淀滴定、络合滴定等。
I.如图为某浓度的NaOH溶液滴定10.00mL一定浓度的盐酸的示意图。根据图像

(1)HCl溶液的浓度是__________;NaOH溶液的浓度是_______;
(2)x=________。
(3)若向20mL稀氨水中逐滴加入等浓度的盐酸,则下列变化趋势正确的是________(填字母)。


ΙΙ.氧化还原滴定实验与中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。
(4)人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度,抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL KMnO4溶液。
滴定的实验数据如下所示:
实验编号 | 待测血液的体积/mL | 滴入KMnO4溶液的体积/mL |
1 | 20.00 | 11.95 |
2 | 20.00 | 13.00 |
3 | 20.00 | 12.05 |
①滴定时,盛放高锰酸钾溶液的仪器名称为_________确定反应达到终点的现象_____________。
②草酸跟酸性KMnO4溶液反应的离子方程式为:2MnO42-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,根据所给数据计算血液样品中Ca2+离子的浓度为__________mg/cm3
【题目】电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
(1)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为__________________。
(2)25 ℃时,pH=3的CH3COOH溶液和pH=11的NaOH溶液混合,若所得溶液显酸性,则c(Na+)__________c(CH3COO-)(填“>”、“<”或“=”)。
(3)NaCN溶液中通入少量CO2,所发生反应的化学方程式为___________。
(4)25 ℃时, pH=8的CH3COONa溶液中,c(Na+)-c(CH3COO-)=___________。