题目内容
【题目】氯化铵俗称卤砂,主要用于干电池、化肥等。某化学研究小组设计如图实验制备卤砂并进行元素测定。
Ⅰ.实验室制备卤砂所需的装置如图所示,装置可重复选用。
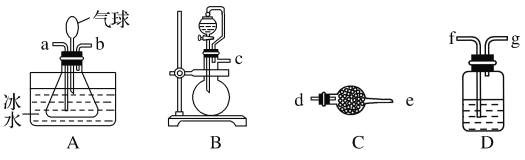
(1)装置接口连接顺序是___→a;b←___。
(2)C装置的作用是___,D装置盛装的物质是___。
(3)写出用上述装置制备氨气的一组试剂:___。
Ⅱ.测定卤砂中Cl元素和N元素的质量之比。
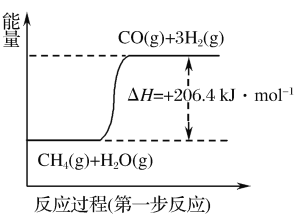
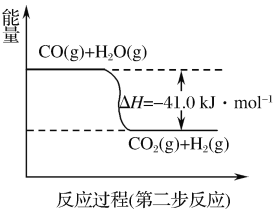
该研究小组准确称取ag卤砂,与足量氧化铜混合加热,充分反应后把气体产物按如图装置进行实验。收集装置收集到的气体为空气中含量最多的气体,其体积换算成标准状况下的体积为VL,碱石灰增重bg。
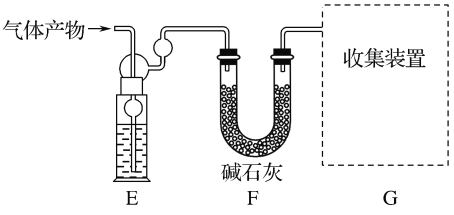
(4)E装置内的试剂为___,卤砂与氧化铜混合加热反应的化学方程式为___。
(5)卤砂中Cl元素和N元素的质量之比为___(用含b、V的式子表示)。
(6)为了测定卤砂中氯元素的质量,他们设计的实验方案是将ag卤砂完全溶解于水,加入过量AgNO3溶液,然后测定生成沉淀的质量。请你评价该方案是否合理,并说明理由:___。
【答案】c→d→e c→f→g 干燥NH3 浓硫酸 浓氨水和碱石灰(或其他合理答案) 浓硫酸 2NH4Cl+3CuO![]() 3Cu+N2↑+2HCl↑+3H2O
3Cu+N2↑+2HCl↑+3H2O ![]() :
:![]() (或
(或![]() :
:![]() ) 合理,氯化铵样品纯净,溶于水后其电离出的氯离子全部沉淀,故通过沉淀质量可求得氯元素的质量(或不合理,氨化铵样品不纯,杂质离子也发生了沉淀反应)
) 合理,氯化铵样品纯净,溶于水后其电离出的氯离子全部沉淀,故通过沉淀质量可求得氯元素的质量(或不合理,氨化铵样品不纯,杂质离子也发生了沉淀反应)
【解析】
(1).制取氯化铵,可以由氨气和氯化氢反应制备,应该选用B装置分别制备氨气和氯化氢,干燥除杂后通入A中反应,根据氨气的密度小于氯化氢,应该由b口通入氨气,a口通入氯化氢,据此可知装置接口连接顺序;
(2).根据上述分析,C装置中装入碱石灰可以干燥氨气,D装置盛装浓硫酸可以干燥氯化氢;
(3).根据装置B不需要加热的特点分析制取氨气的试剂;
(4).收集装置收集到的气体为空气中含量最多的气体为氮气,说明氯化铵与氧化铜混合加热生成氮气,结合电子守恒应该还会生成铜,据此书写该反应的化学方程式;F中的碱石灰可以吸收氯化氢,则E装置内可以装入浓硫酸,吸收水蒸汽,G装置中收集氮气;
(5).根据![]() 计算出氮气的物质的量,根据
计算出氮气的物质的量,根据![]() 计算出HCl的物质的量,然后结合m=nM计算出卤砂中Cl元素和N元素的质量之比;
计算出HCl的物质的量,然后结合m=nM计算出卤砂中Cl元素和N元素的质量之比;
(6).若氯化铵纯净,其电离出的氯离子全部沉淀,通过沉淀质量可以求得氯离子质量,则方案合理;若氯化铵不纯,杂质离子也发生了沉淀反应等,则测定不准确,该方案不合理,以此来解答。
(1).结合实验目的及题给装置可知,从a、b接口分别向锥形瓶中通入NH3和HCl,可用B装置制备HCl,经D装置干燥后通入b,装置接口连接顺序为c→f→g→b;也可用B装置制备NH3,经C装置干燥后通入a,装置接口连接顺序为c→d→e→a,故答案为:c→d→e;c→f→g;
(2).C装置用于干燥NH3,D装置用于干燥HCl,盛装的物质是浓硫酸,故答案为:干燥NH3;浓硫酸;
(3).用B装置制备NH3可选用浓氨水和碱石灰,故答案为:浓氨水和碱石灰;
(4).NH4Cl与CuO的反应为2NH4Cl+3CuO![]() 3Cu+N2↑+2HCl↑+3H2O,装置E内盛装浓硫酸,可用于干燥气体,故答案为:浓硫酸;2NH4Cl+3CuO
3Cu+N2↑+2HCl↑+3H2O,装置E内盛装浓硫酸,可用于干燥气体,故答案为:浓硫酸;2NH4Cl+3CuO![]() 3Cu+N2↑+2HCl↑+3H2O;
3Cu+N2↑+2HCl↑+3H2O;
(5).装置F中碱石灰增加的重量等于HCl的质量,装置G中收集到的气体为N2,则卤砂中Cl元素与N元素的质量之比为![]() ∶
∶![]() ×28=
×28=![]() ∶
∶![]() ,故答案为:
,故答案为:![]() :
:![]() (或
(或![]() :
:![]() );
);
(6).若NH4Cl样品纯净,其完全溶于水后,加入过量AgNO3溶液,溶液中的Cl-完全转化为AgCl,根据AgCl的质量可确定NH4Cl样品中Cl元素的质量;若NH4Cl样品不纯,混有的杂质离子也发生沉淀反应,则不能根据生成沉淀的质量确定NH4Cl样品中Cl元素的质量;故答案为:合理,氯化铵样品纯净,溶于水后其电离出的氯离子全部沉淀,故通过沉淀质量可求得氯元素的质量(或不合理,氨化铵样品不纯,杂质离子也发生了沉淀反应)。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,实验信息如下:
实验编号 | c(HA)/ mol·L-1 | c(NaOH)/ mol·L-1 | 反应后溶液pH |
甲 | 0.1 | 0.1 | pH=9 |
乙 | c1 | 0.2 | pH=7 |
下列判断不正确的是
A.c1一定大于0.2 mol·L-1
B.HA的电离方程式是HA![]() H++A-
H++A-
C.甲反应后溶液中:c(Na+) > c(OH-)> c(A-) > c(H+)
D.乙反应后溶液中:c(Na+) < c(HA)+c(A-)
【题目】25℃时,浓度均为0.1mol/L的溶液,其pH如下表所示。有关说法正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | CH3COONa |
pH | 7.0 | 7.0 | 8.1 | 8.9 |
A.酸性强弱:CH3COOH>HF
B.离子的总浓度:①>③
C.②中:c(CH3COO-)=c(NH4+)=c(OH-)=c(H+)
D.②和④中c(CH3COO-)相等