题目内容
【题目】常温下用NaOH溶液滴定H2C2O4溶液的过程中,溶液中-lg![]() 和-lg c(HC2O4-)或-lg
和-lg c(HC2O4-)或-lg![]() 和-lg c(C2O42-)的关系如图所示。下列说法正确的是( )
和-lg c(C2O42-)的关系如图所示。下列说法正确的是( )
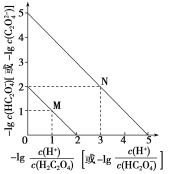
A.Ka1(H2C2O4)数量级为10-1
B.曲线N表示-lg![]() 和-lg c(HC2O4-)的关系
和-lg c(HC2O4-)的关系
C.向NaHC2O4溶液中加NaOH至c(HC2O4-)和c(C2O4-)相等,此时溶液pH约为5
D.在NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
【答案】C
【解析】
H2C2O4溶液存在H2C2O4HC2O4-+H+,HC2O4-C2O42-+H+,Ka1(H2C2O4)=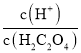 ×c(HC2O4-),Ka2(H2C2O4)=
×c(HC2O4-),Ka2(H2C2O4)=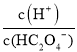 ×c(C2O42-),[-lg
×c(C2O42-),[-lg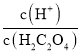 ]+[-lgc(HC2O4-)]=-lg(Ka1),[-lg
]+[-lgc(HC2O4-)]=-lg(Ka1),[-lg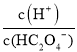 ]+[-lgc(C2O42-)]=-lg(Ka2),因Ka1>Ka2,则-lg(Ka1)<-lg(Ka2),可知曲线M表示-lg
]+[-lgc(C2O42-)]=-lg(Ka2),因Ka1>Ka2,则-lg(Ka1)<-lg(Ka2),可知曲线M表示-lg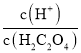 和-lgc(HC2O4-)的关系,曲线N表示-lg
和-lgc(HC2O4-)的关系,曲线N表示-lg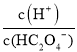 和-lgc(C2O42-)]的关系。
和-lgc(C2O42-)]的关系。
A.根据上述分析,因为-lg -lg c(HC2O
-lg c(HC2O![]() )=2,则Ka1(H2C2O4)=
)=2,则Ka1(H2C2O4)=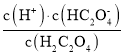 =10-2,数量级为10-2,故A错误;
=10-2,数量级为10-2,故A错误;
B.H2C2O4为弱酸,第一步电离平衡常数>第二步电离平衡常数,即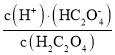 >
>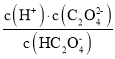 ,则lg
,则lg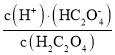 >lg
>lg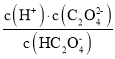 ,则-lg
,则-lg -lgc(HC2O4-)<-lg
-lgc(HC2O4-)<-lg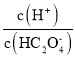 -lgc(C2O42-),因此曲线M表示-lg
-lgc(C2O42-),因此曲线M表示-lg 和-lg c(HC2O4-)的关系,曲线N表示-lg
和-lg c(HC2O4-)的关系,曲线N表示-lg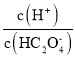 和-lgc(C2O42-)的关系,故B错误;
和-lgc(C2O42-)的关系,故B错误;
C.根据A的分析,Ka2(H2C2O4)=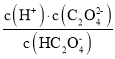 =10-5,向NaHC2O4溶液中加NaOH至c(HC2O4-)和c(C2O42-)相等,Ka2(H2C2O4)=c(H+)=10-5,此时溶液pH约为5,故C正确;
=10-5,向NaHC2O4溶液中加NaOH至c(HC2O4-)和c(C2O42-)相等,Ka2(H2C2O4)=c(H+)=10-5,此时溶液pH约为5,故C正确;
D. 根据A的分析,Ka1(H2C2O4)=10-2,则NaHC2O4的水解平衡常数![]() =10-12<Ka2(H2C2O4),说明以电离为主,溶液显酸性,但是其电离和水解程度都较小,钠离子不水解,钠离子浓度最大,则c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4),故D错误;
=10-12<Ka2(H2C2O4),说明以电离为主,溶液显酸性,但是其电离和水解程度都较小,钠离子不水解,钠离子浓度最大,则c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4),故D错误;
答案选C。

【题目】下表是室温下,几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb):
酸或碱 | 电离常数(Ka或Kb) |
CH3COOH | Ka=1.75×10-5 |
柠檬酸(H3C6H5O7) | Ka1=7.4×10-4 Ka2=1.73×10-5 Ka3=4.0×10-7 |
NH3·H2O | Kb=1.75×10-5 |
请回答下列问题:
(1)用蒸馏水稀释0.1 mol/L的醋酸溶液,下列选项中一定变小的是__________(填字母)。
A.![]()
B.c(H+)
C.c(OH-)·c(H+)
D.![]()
E.![]()
(2)浓度为0.10 mol/L柠檬酸氢二钠(Na2HC6H5O7)溶液显_____(填“酸”“碱”或“中”)性,通过计算说明其原因____
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,实验信息如下:
实验编号 | c(HA)/ mol·L-1 | c(NaOH)/ mol·L-1 | 反应后溶液pH |
甲 | 0.1 | 0.1 | pH=9 |
乙 | c1 | 0.2 | pH=7 |
下列判断不正确的是
A.c1一定大于0.2 mol·L-1
B.HA的电离方程式是HA![]() H++A-
H++A-
C.甲反应后溶液中:c(Na+) > c(OH-)> c(A-) > c(H+)
D.乙反应后溶液中:c(Na+) < c(HA)+c(A-)
【题目】25℃时,浓度均为0.1mol/L的溶液,其pH如下表所示。有关说法正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | CH3COONa |
pH | 7.0 | 7.0 | 8.1 | 8.9 |
A.酸性强弱:CH3COOH>HF
B.离子的总浓度:①>③
C.②中:c(CH3COO-)=c(NH4+)=c(OH-)=c(H+)
D.②和④中c(CH3COO-)相等