题目内容
【题目】CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
已知:①CuCl可以由CuCl2用适当的还原剂如SO2,SnCl2等还原制得:2Cu2++2Cl-+SO2+2H2O![]() 2CuCl↓+4H++SO42-,2CuCl2+SnCl2=2CuCl↓+SnCl4,②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子:
2CuCl↓+4H++SO42-,2CuCl2+SnCl2=2CuCl↓+SnCl4,②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子:  。
。
请回答下列问题:
(1)基态Cu原子的核外电子排布式为_____;H、N、O三种元素的电负性由大到小的顺序是____。
(2)SO2分子的空间构型为________;与SnCl4互为等电子体的一种离子的化学式为________。
(3)乙二胺分子中氮原子轨道的杂化类型为________。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是__________。
(4)②中所形成的配离子中含有的化学键类型有______(填字母)。
A.配位键 B.极性键 C.离子键 D.非极性键
【答案】[Ar]3d104s1 O>N>H V形 SO42—、SiO44— sp3杂化 乙二胺分子间能形成氢键而三甲胺分子之间不能形成氢键 ABD
【解析】
(1)根据铜的原子序数为29,结合能量最低原理书写基态原子的电子排布式;根据电负性的变化规律比较电负性大小;(2)根据SO2分子含有的δ键以及孤电子对数判断空间构型;根据SnCl4含有的最外层电子数为50,以及含有5个原子判断等电子体;(3)根据价层电子对数判断乙二胺(H2N—CH2—CH2—NH2)分子中氮原子的杂化类型,根据是否含有氢键分析二者熔沸点高低不同的原因;(4)根据成键原子的特点,结合化学键的类型判断。
(1)铜的原子序数为29,根据能量最低原理基态原子的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1;在元素周期表中同一周期从左到右元素的电负性逐渐增强,同一主族从上到下元素的电负性逐渐减弱,可知电负性强弱顺序为O>N>H,故答案为:1s22s22p63s23p63d104s1或[Ar]3d104s1;O>N>H;
(2)SO2分子中含有2个δ键,孤电子对数=![]() =1,所以分子的空间构型为V形,SnCl4含有的价层电子数为50,并含有5个原子,与之互为等电子体的离子有SO42-、SiO44-等,故答案为:V形;SO42-、SiO44-等;
=1,所以分子的空间构型为V形,SnCl4含有的价层电子数为50,并含有5个原子,与之互为等电子体的离子有SO42-、SiO44-等,故答案为:V形;SO42-、SiO44-等;
(3)乙二胺(H2N—CH2—CH2—NH2)分子中氮原子形成4个δ键,价层电子对数为4,氮原子为sp3杂化,乙二胺分子间可以形成氢键,物质的熔沸点较高,而三甲胺分子间不能形成氢键,熔沸点较低,故答案为:sp3杂化;乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键;
(4)②中所形成的配离子(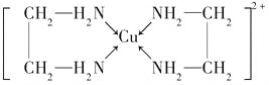 )中含有的化学键有N与Cu之间为配位键,C-C键为非极性键,C-N、N-H、C-H键为极性键,不含离子键,故答案为:ABD。
)中含有的化学键有N与Cu之间为配位键,C-C键为非极性键,C-N、N-H、C-H键为极性键,不含离子键,故答案为:ABD。

 名校课堂系列答案
名校课堂系列答案








