题目内容
【题目】某温度下,向容积可变的密闭容器中充入醋酸的二聚物![]() ,发生反应:
,发生反应:![]() 。测得平衡时混合气体的平均摩尔质量
。测得平衡时混合气体的平均摩尔质量![]() 与温度
与温度![]() 、压强
、压强![]() 的关系如图所示。下列有关说法错误的是( )
的关系如图所示。下列有关说法错误的是( )
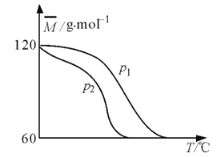
A.![]()
B.当![]() 时,平衡常数
时,平衡常数![]()
C.保持温度不变,增大压强,平衡左移,![]() 增大
增大
D.![]() 条件下,保持温度不变,向容器中加入少量
条件下,保持温度不变,向容器中加入少量![]() ,
,![]() 平衡转化率增大
平衡转化率增大
【答案】B
【解析】
A. 由图可知,随着温度的升高,平均摩尔质量减小,反应正向移动,正反应为吸热反应,![]() ,A正确;
,A正确;
B. 根据图像分析可知,![]() ,当
,当![]() 时,
时,

平衡常数![]() ,B错误;
,B错误;
C. 该反应为反应前后气体分子数增大的反应,增大压强,平衡逆向移动,平均摩尔质量增大,C正确;
D. 容积可变的密闭容器中加入少量![]() ,体积变大,压强减小,平衡正向移动,
,体积变大,压强减小,平衡正向移动,![]() 平衡转化率增大,D正确;故答案为:B。
平衡转化率增大,D正确;故答案为:B。

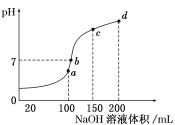
【题目】25℃时,浓度均为0.1mol/L的溶液,其pH如下表所示。有关说法正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | CH3COONa |
pH | 7.0 | 7.0 | 8.1 | 8.9 |
A.酸性强弱:CH3COOH>HF
B.离子的总浓度:①>③
C.②中:c(CH3COO-)=c(NH4+)=c(OH-)=c(H+)
D.②和④中c(CH3COO-)相等
【题目】科学家们致力于消除氮氧化物对大气的污染。回答下列问题:
(1)NO在空气中存在如下反应:2NO(g)+O2(g)![]() 2NO2(g) ΔH,该反应共有两步第一步反应为2NO(g)
2NO2(g) ΔH,该反应共有两步第一步反应为2NO(g)![]() N2O2(g) ΔH1<0;请写出第二步反应的热化学方程式(ΔH2用含ΔH、ΔH1的式子来表示):_______________________________________。
N2O2(g) ΔH1<0;请写出第二步反应的热化学方程式(ΔH2用含ΔH、ΔH1的式子来表示):_______________________________________。
(2)温度为T1时,在两个容积均为1 L的恒容密闭容器中仅发生反应:2NO2(g)![]() 2NO(g)+O2(g),容器I中5min达到平衡。相关数据如表所示:
2NO(g)+O2(g),容器I中5min达到平衡。相关数据如表所示:
容器编号 | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
I | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
①容器Ⅱ在反应的起始阶段向_____(“正反应”、“逆反应”、“达平衡”)方向进行。
②达到平衡时,容器I与容器Ⅱ中的总压强之比为___________
a. >1 b. =1 c. <1

(3)NO2存在如下平衡:2NO2(g)![]() N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:υ(NO2)=k1·p2(NO2),υ(N2O4)=k2·P(N2O4),相应的速率与其分压关系如图所示。一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间关系是k1=______;在上图标出点中,指出能表示反应达到平衡状态的点是_____,理由是______________。
N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:υ(NO2)=k1·p2(NO2),υ(N2O4)=k2·P(N2O4),相应的速率与其分压关系如图所示。一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间关系是k1=______;在上图标出点中,指出能表示反应达到平衡状态的点是_____,理由是______________。
(4)可用NH3去除 NO,其反应原理4NH3+6NO=5N2+6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为 4:1、3:1、1:3时,得到NO脱除率曲线如图所示:
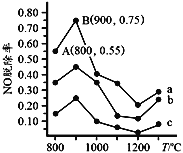
①曲线a中,NO的起始浓度为6×10-4 mg·m-3,从A点到B点经过0.8 s,该时间段内NO的脱除速率为_______mg/(m3·s)。
②曲线b对应NH3与NO的物质的量之比是_____。
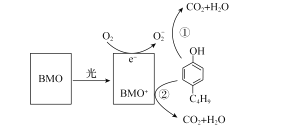
(5)还可用间接电解法除NO。其原理如图所示:

①从A口中出来的物质的是__________________。
②写出电解池阴极的电极反应式_______________。
③用离子方程式表示吸收池中除去NO的原理__________________。