题目内容
【题目】亚硝酰氯(ClNO)是有机合成中常用的试剂。
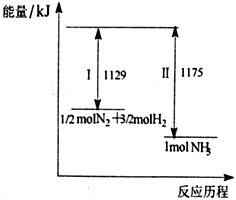
巳知:①2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g)△H1=akJ·mol-1
NaNO3(s)+ClNO(g)△H1=akJ·mol-1
②4NO2(8)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)△H2=bkJ·mol-1
2NaNO3(s)+2NO(g)+Cl2(g)△H2=bkJ·mol-1
③2NO(g)+Cl2(g)![]() 2ClNO(g)△H3=ckJ·mol-1
2ClNO(g)△H3=ckJ·mol-1
(1)上述反应中,a、b、c之间满足的关系为_____________________。
(2)某温度下,在密闭容器中发生反应:2NO(g)+Cl2(g)![]() 2ClNO(g),正反应速率表达式为v正=k·cn(NO)·cm(Cl2)(k是反应速率常数,只与温度有关;n、m为反应级数,只取正数)。测得正反应速率与浓度的关系如下表所示:
2ClNO(g),正反应速率表达式为v正=k·cn(NO)·cm(Cl2)(k是反应速率常数,只与温度有关;n、m为反应级数,只取正数)。测得正反应速率与浓度的关系如下表所示:
序号 | c(NO)/mol·L-1 | c(Cl2)/mol·L-1 | v正/mol·L-1·min-1 |
ⅰ | 0.100 | 0.100 | 0.144 |
ⅱ | 0.100 | 0.200 | 0.288 |
ⅲ | 0.200 | 0.100 | 0.576 |
①n=_____________,m=_____________。
②反应达到平衡后,其他条件不变时,缩小容器体积瞬间,v正_____________v逆(填“>"“<”或“=")。NO的平衡转化率_____________(填“增大”“减小”或“不变”)。
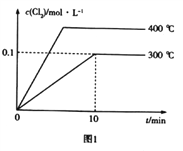
(3)在2L恒容密闭容器中充入0.8molClNO(g),发生反应:2ClNO(g)![]() Cl2(g)+2NO(g) △H,测得c(Cl2)与温度和时间的关系如图1所示。300℃时达到平衡后,温度与平衡常数负对数(-lgK)的关系如图2所示。
Cl2(g)+2NO(g) △H,测得c(Cl2)与温度和时间的关系如图1所示。300℃时达到平衡后,温度与平衡常数负对数(-lgK)的关系如图2所示。

①a=_____________。
②图2中符合题意的曲线为_____________(填“Ⅰ”或“Ⅱ”)。
【答案】 2a=b+c(或c=2a-b或b=2a-c) 2 1 > 增大 1 Ⅱ
【解析】(1)由①![]() ②得2NO(g)+Cl2(g)
②得2NO(g)+Cl2(g)![]() 2ClNO(g),所以△H3= 2akJ·mol-1- bkJ·mol-1= ckJ·mol-1,因此,上述反应中,a、b、c之间满足的关系为2a=b+c(或c=2a-b或b=2a-c)。
2ClNO(g),所以△H3= 2akJ·mol-1- bkJ·mol-1= ckJ·mol-1,因此,上述反应中,a、b、c之间满足的关系为2a=b+c(或c=2a-b或b=2a-c)。
(2)①将ⅰ、ⅱ两组数据代入v正=k·cn(NO)·cm(Cl2)中,可以求出m=1:将ⅰ、ⅲ两组数据代入v正=k·cn(NO)·cm(Cl2)中,可以求出n=2,即n=2、m=1。
②反应2NO(g)+Cl2(g)![]() 2ClNO(g)达到平衡后,其他条件不变时,缩小容器体积瞬间,正反应速率和逆反应速率均增大,化学平衡向正反应方向移动,所以v正>v逆、NO的平衡转化率增大。
2ClNO(g)达到平衡后,其他条件不变时,缩小容器体积瞬间,正反应速率和逆反应速率均增大,化学平衡向正反应方向移动,所以v正>v逆、NO的平衡转化率增大。
(3)①在2L恒容密闭容器中充入0.8molClNO(g),则c(ClNO)=0.4mol/L。由图1可知,在300℃时达到平衡后,c(Cl2)=0.1mol/L,由发生的反应2ClNO(g)![]() Cl2(g)+2NO(g)可知,另外两组分的平衡浓度均为0.2mol/L,所以该反应在此温度下的平衡常数K=
Cl2(g)+2NO(g)可知,另外两组分的平衡浓度均为0.2mol/L,所以该反应在此温度下的平衡常数K=![]() ,a=-lgK=1。
,a=-lgK=1。
②由图1可知,在400℃,氯气的平衡浓度较高,说明温度升高后,化学平衡向正反应方向移动,所以该反应为吸热反应,温度越高,其化学平衡常数越大,-lgK就越小。因此,图2中符合题意的曲线为Ⅱ。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案【题目】镁及其化合物是实验设计的热点载体,查阅资料。
ⅰ | 2NO2+2NaOH=NaNO2+NaNO3+H2O |
ⅱ | Mg3N2与水反应 |
ⅲ | 常温下,NH3·H2O、CH3COOH的电离常数都等于1.8×10-5 |
Ⅰ.探究镁的性质。
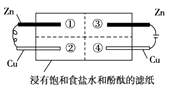
某学习小组设计实验探究镁与二氧化氮反应的产物,实验装置如图所示。

(1)B中试剂是_____________;D装置的作用是______________________________。
(2)实验时,先启动A中反应,当C装置中充满红棕色气体时点燃酒精灯,这样操作的目的是____________________________________________________________________________。
(3)确定有N2生成的实验现象是_______________________________________________________。
(4)实验完毕后,设计实验确认产物中有Mg3N2取少量C中残留固体于试管中,滴加蒸馏水,_____________________,则产物中有氮化镁。
(5)经测定,Mg与NO2反应生成MgO、Mg3N2和N2,其中Mg3N2和N2的物质的量相等。C中发生反应的化学方程式为_____________________________________________________。
Ⅱ.探究Mg(OH)2在氯化铵溶液中溶解的原因。供选试剂有:氢氧化镁、蒸馏水、硝酸氨溶液、盐酸、醋酸铵溶液。
取少量氢氧化镁粉末投入氯化氨溶液中,振荡、白色粉末全部溶解。为了探究其原因,他们提出两种假设。
假设1:氯化铵溶液呈酸性,H++OH-=H2O,促进Mg(OH)2溶解;
假设2:NH4++OH-=NH3·H2O,促进Mg(OH)2溶解。
(6)请你帮他们设计实验探究哪一种假设正确:____________________________________________。