题目内容
【题目】下列变化中释放能量的是( )
A. 1s22s22p63s1→1s22s22p6
B. N≡N(g)→N(g)+N(g)
C. 2p2p2p→2p2p2p
D. 2H(g)→H-H(g)
【答案】D
【解析】A、失去3s电子,要吸收能量,A错误;B、共价键断裂,吸收能量,B错误;C、2px、2py、2pz的能量相等,无能量变化,C错误;D、形成共价键,释放能量,D正确,答案选D。

【题目】用金属钴板(含少量Fe、Ni)制备应用广泛的氯化钴的工艺流程如下:
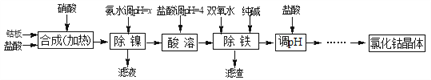
注:钴与盐酸反应极慢,需加入催化剂硝酸才可能进行实际生产。
有关钴、镍和铁化合物的性质见下表:
化学式 | 沉淀完全时的pH | 钴镍性质 |
Co(OH)2 | 9.4 | Co+2HCl=CoCl2+H2↑ Co2++2NH3·H2O=Co(OH)2↓+2NH4+ Co2++2H2O Ni+2HCl=NiCl2+H2↑ Ni2++6NH3·H2O=[Ni(NH3)6]2++6H2O |
Fe(OH)2 | 9.6 | |
Fe (OH)3 | 3.7 |
(1)“除镍”步骤中,NH3·H2O用量对反应收率的影响见表中数据:从表中数据可知,当PH调节至x=_______时,除镍效果最好。
加NH3·H2O调pH | 收率/% | Ni2+含量/% |
9 | 98.1 | 0.08 |
9.5 | 98 | 0.05 |
10 | 97.6 | 0.005 |
10.3 | 94 | 0.005 |
(2)“除镍”步骤必须控制在一定的时间内完成,否则沉淀中将有部分Co(OH)2转化为Co(OH)3,此反应的化学方程式为________________。
(3)“除铁”步骤中加入双氧水发生反应的离子方程式是________________________。
(4)“除铁”步骤中加入的纯碱作用是_______________________________。
(5)在“调pH”步骤中,加盐酸的作用是______________________________。
(6)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O![]() Fe(OH)3+3H+的平衡常数为_____________________。
Fe(OH)3+3H+的平衡常数为_____________________。
【题目】化学反应的快慢和限度对人类生产、生活有重要的意义。
(1)将影响化学反应速率的因素镇在空格处。
实例 | 影响因素 |
食物放在冰箱里延长保质期 | ①___ |
实验室将块状药品研细,再进行反应 | ②___ |
(2)某小组将酸性KMnO4溶液与H2C2O4(具有还原性)溶液混合,用反应中溶液紫色消失快慢的方法研究形响化学反应速率的因素。实验中酸性KMnO4溶液(0.0010mol/L)、H2C2O4溶液的用量均为4mL(忽略加入固体,溶液混合时体积的变化)。
①该反应中氧化剂与还原剂的物质的量之比为________。
②请帮助他们完成以下实验设计表:填写IV中的数据,并将实验目的补充完整。
实验编号 | 温度/K | 催化剂的用量/g | H2C2O4溶液的浓度/mol.L-1 | 实验目的 |
I | 298 | 0.5 | 0.010 | A.实验I和II探究____对反应速率的影响 B.实验I和III探究____对反应速率的影响 C.实验I和IV探究催化剂对反应速率的影响 |
II | 298 | 0.5 | 0.050 | |
III | 323 | 0.5 | 0.010 | |
IV | ____ | ____ | ____ |
③该小组同学对实验II进行了3次实验,测得以下数据:
实验编号 | 溶液退色所需时问t/min | ||
第1次 | 第2次 | 第3次 | |
II | 4.9 | 5.1 | 5.0 |
实验II中用KMnO4表示该反应的平均反应速率为____。
【题目】亚硝酰氯(ClNO)是有机合成中常用的试剂。
巳知:①2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g)△H1=akJ·mol-1
NaNO3(s)+ClNO(g)△H1=akJ·mol-1
②4NO2(8)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)△H2=bkJ·mol-1
2NaNO3(s)+2NO(g)+Cl2(g)△H2=bkJ·mol-1
③2NO(g)+Cl2(g)![]() 2ClNO(g)△H3=ckJ·mol-1
2ClNO(g)△H3=ckJ·mol-1
(1)上述反应中,a、b、c之间满足的关系为_____________________。
(2)某温度下,在密闭容器中发生反应:2NO(g)+Cl2(g)![]() 2ClNO(g),正反应速率表达式为v正=k·cn(NO)·cm(Cl2)(k是反应速率常数,只与温度有关;n、m为反应级数,只取正数)。测得正反应速率与浓度的关系如下表所示:
2ClNO(g),正反应速率表达式为v正=k·cn(NO)·cm(Cl2)(k是反应速率常数,只与温度有关;n、m为反应级数,只取正数)。测得正反应速率与浓度的关系如下表所示:
序号 | c(NO)/mol·L-1 | c(Cl2)/mol·L-1 | v正/mol·L-1·min-1 |
ⅰ | 0.100 | 0.100 | 0.144 |
ⅱ | 0.100 | 0.200 | 0.288 |
ⅲ | 0.200 | 0.100 | 0.576 |
①n=_____________,m=_____________。
②反应达到平衡后,其他条件不变时,缩小容器体积瞬间,v正_____________v逆(填“>"“<”或“=")。NO的平衡转化率_____________(填“增大”“减小”或“不变”)。
(3)在2L恒容密闭容器中充入0.8molClNO(g),发生反应:2ClNO(g)![]() Cl2(g)+2NO(g) △H,测得c(Cl2)与温度和时间的关系如图1所示。300℃时达到平衡后,温度与平衡常数负对数(-lgK)的关系如图2所示。
Cl2(g)+2NO(g) △H,测得c(Cl2)与温度和时间的关系如图1所示。300℃时达到平衡后,温度与平衡常数负对数(-lgK)的关系如图2所示。
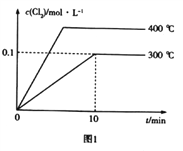
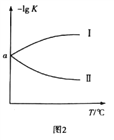
①a=_____________。
②图2中符合题意的曲线为_____________(填“Ⅰ”或“Ⅱ”)。