题目内容
【题目】碲及其化合物是半导体材料。
(1)25℃时,H2TeO3(亚碲酸):Ka1=1.0×10-3、Ka2=2.0×10-8。在该温度下,0.1mol·L-1H2TeO3溶液的pH约为_____________(填代号)。
A.0.7 B.1 C.2 D.5
NaHTeO3溶液中,H2TeO3、HTeO3-、TeO32-浓度大小的排序为____________________。
(2)工业上,常用铜阳极泥(主要成分是Cu2Te,含少量的Ag、Au)冶炼碲,其工艺流程如下(已知TeO2微溶于水,易与浓强碱.浓强酸反应):
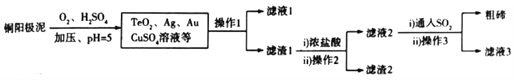
①铜阳极泥溶于硫酸时加压的目的是_____________________________________________;
若调节pH时,pH过低,则粗碲产率会_____________(填“增大”“减小”或“不变”)。
②上述流程中可以循环利用的物质是____________________。
③写出铜阳极泥转化成TeO2的化学方程式:___________________________________________。
【答案】 C HTeO3->TeO32->H2TeO3 增大氧气浓度,提高反应速率 减小 H2SO4、HCl Cu2Te+2O2+2H2SO4=2CuSO4+TeO2+2H2O
【解析】(1)25℃时,H2TeO3(亚碲酸):Ka1=1.0×10-3、Ka2=2.0×10-8。在该温度下,0.1mol·L-1H2TeO3溶液中,c(H+)![]() mol/L,则pH约为2,选C。
mol/L,则pH约为2,选C。
NaHTeO3溶液中,既可以电离又可以水解,其水解平衡常数为Kh=![]() < Ka2,所以HTeO3-的电离程度大于其水解程度,故H2TeO3、HTeO3-、TeO32-浓度大小的排序为HTeO3->TeO32->H2TeO3。
< Ka2,所以HTeO3-的电离程度大于其水解程度,故H2TeO3、HTeO3-、TeO32-浓度大小的排序为HTeO3->TeO32->H2TeO3。
(2)由流程可知,铜阳极泥在加压条件下与氧气、硫酸反应,Cu2Te转化为硫酸铜、二氧化碲,过滤后得滤渣1,滤渣1中TeO2与浓盐酸反应后转化为四氯化碲,过滤除去不溶物金、银等,得滤液2,向滤液2中通入二氧化硫发生反应TeCl4+2SO2+4H2O=Te+ 2H2SO4+4HCl,过滤得到粗碲。
①铜阳极泥溶于硫酸时,氧气是氧化剂,所以加压的目的是增大氧气浓度,提高反应速率;若调节pH时,pH过低,因为TeO2易与浓的强酸反应,则粗碲产率会减小。
②由上述分析可知,流程中可以循环利用的物质是H2SO4、HCl。
③铜阳极泥转化成TeO2的化学方程式为Cu2Te+2O2+2H2SO4=2CuSO4+TeO2+2H2O。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】亚硝酰氯(ClNO)是有机合成中常用的试剂。
巳知:①2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g)△H1=akJ·mol-1
NaNO3(s)+ClNO(g)△H1=akJ·mol-1
②4NO2(8)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)△H2=bkJ·mol-1
2NaNO3(s)+2NO(g)+Cl2(g)△H2=bkJ·mol-1
③2NO(g)+Cl2(g)![]() 2ClNO(g)△H3=ckJ·mol-1
2ClNO(g)△H3=ckJ·mol-1
(1)上述反应中,a、b、c之间满足的关系为_____________________。
(2)某温度下,在密闭容器中发生反应:2NO(g)+Cl2(g)![]() 2ClNO(g),正反应速率表达式为v正=k·cn(NO)·cm(Cl2)(k是反应速率常数,只与温度有关;n、m为反应级数,只取正数)。测得正反应速率与浓度的关系如下表所示:
2ClNO(g),正反应速率表达式为v正=k·cn(NO)·cm(Cl2)(k是反应速率常数,只与温度有关;n、m为反应级数,只取正数)。测得正反应速率与浓度的关系如下表所示:
序号 | c(NO)/mol·L-1 | c(Cl2)/mol·L-1 | v正/mol·L-1·min-1 |
ⅰ | 0.100 | 0.100 | 0.144 |
ⅱ | 0.100 | 0.200 | 0.288 |
ⅲ | 0.200 | 0.100 | 0.576 |
①n=_____________,m=_____________。
②反应达到平衡后,其他条件不变时,缩小容器体积瞬间,v正_____________v逆(填“>"“<”或“=")。NO的平衡转化率_____________(填“增大”“减小”或“不变”)。
(3)在2L恒容密闭容器中充入0.8molClNO(g),发生反应:2ClNO(g)![]() Cl2(g)+2NO(g) △H,测得c(Cl2)与温度和时间的关系如图1所示。300℃时达到平衡后,温度与平衡常数负对数(-lgK)的关系如图2所示。
Cl2(g)+2NO(g) △H,测得c(Cl2)与温度和时间的关系如图1所示。300℃时达到平衡后,温度与平衡常数负对数(-lgK)的关系如图2所示。
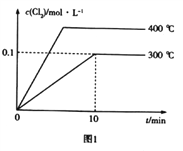
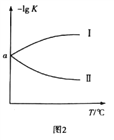
①a=_____________。
②图2中符合题意的曲线为_____________(填“Ⅰ”或“Ⅱ”)。

