��Ŀ����
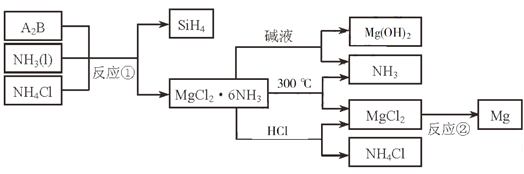
����Ŀ��N2(g)��H2(g)��һ�������·�Ӧ����NH3(g)����������ͼ������˵����ȷ����
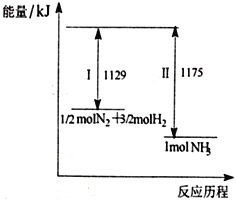
A. IΪ���ȹ��̡���Ϊ���ȹ���
B. 1/2 molN2��3/2molH2�ļ���֮�ʹ���1 mol NH3�ļ���
C. 1/2molN2��3/2molH2�����е�����֮�͵���1 mol NH3�����е�����
D. �ù��̵��Ȼ�ѧ��Ӧ����ʽΪN2(g)+3H2(g)![]() 2NH3(g) ��H=-92 kJ/mol
2NH3(g) ��H=-92 kJ/mol
���𰸡�D
������������ͼ���֪��Ӧ�����������������������������ڷ��ȷ�Ӧ����Ӧ�ȵ��ڶϼ����յ����������γɻ�ѧ�����ų����������IJ�ֵ���ݴ˽��
A. IΪ�ϼ����̣�Ϊ���ȹ�������Ϊ�γɻ�ѧ���Ĺ��̣�Ϊ���ȹ�����A������
B. �����Ƿ��ȷ�Ӧ����1/2 molN2��3/2molH2�ļ���֮��С��1 mol NH3�ļ�����B������
C. �����Ƿ��ȷ�Ӧ����1/2molN2��3/2molH2�����е�����֮����1 mol NH3�����е�������C������
D. ����ͼ���֪����1mol�����ķ�Ӧ����1129 kJ/mol��1175 kJ/mol����46 kJ/mol����˸ù��̵��Ȼ�ѧ��Ӧ����ʽΪN2(g)+3H2(g)![]() 2NH3(g) ��H=-92 kJ/mol��D��ȷ��
2NH3(g) ��H=-92 kJ/mol��D��ȷ��
��ѡD��

����Ŀ����������(ClNO)���л��ϳ��г��õ��Լ���
��֪����2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g)��H1=akJ��mol-1
NaNO3(s)+ClNO(g)��H1=akJ��mol-1
��4NO2(8)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)��H2=bkJ��mol-1
2NaNO3(s)+2NO(g)+Cl2(g)��H2=bkJ��mol-1
��2NO(g)+Cl2(g)![]() 2ClNO(g)��H3=ckJ��mol-1
2ClNO(g)��H3=ckJ��mol-1
��1��������Ӧ��,a��b��c֮������Ĺ�ϵΪ_____________________��
��2��ij�¶���,���ܱ������з�����Ӧ��2NO(g)+Cl2(g)![]() 2ClNO(g),����Ӧ���ʱ���ʽΪv��=k��cn(NO)��cm(Cl2)(k�Ƿ�Ӧ���ʳ���,ֻ���¶��й�;n��mΪ��Ӧ����,ֻȡ����)���������Ӧ������Ũ�ȵĹ�ϵ���±���ʾ��
2ClNO(g),����Ӧ���ʱ���ʽΪv��=k��cn(NO)��cm(Cl2)(k�Ƿ�Ӧ���ʳ���,ֻ���¶��й�;n��mΪ��Ӧ����,ֻȡ����)���������Ӧ������Ũ�ȵĹ�ϵ���±���ʾ��
��� | c(NO)/mol��L-1 | c(Cl2)/mol��L-1 | v��/mol��L-1��min-1 |
�� | 0.100 | 0.100 | 0.144 |
�� | 0.100 | 0.200 | 0.288 |
�� | 0.200 | 0.100 | 0.576 |
��n=_____________��m=_____________��
�ڷ�Ӧ�ﵽƽ���,������������ʱ,��С�������˲��,v��_____________v��(����>"��<������=")��NO��ƽ��ת����_____________(��������������С������������)��
��3����2L�����ܱ������г���0.8molClNO(g),������Ӧ��2ClNO(g)![]() Cl2(g)+2NO(g) ��H,���c(Cl2)���¶Ⱥ�ʱ��Ĺ�ϵ��ͼ1��ʾ��300��ʱ�ﵽƽ���,�¶���ƽ�ⳣ��������(-lgK)�Ĺ�ϵ��ͼ2��ʾ��
Cl2(g)+2NO(g) ��H,���c(Cl2)���¶Ⱥ�ʱ��Ĺ�ϵ��ͼ1��ʾ��300��ʱ�ﵽƽ���,�¶���ƽ�ⳣ��������(-lgK)�Ĺ�ϵ��ͼ2��ʾ��
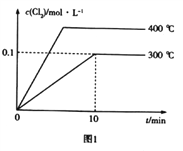
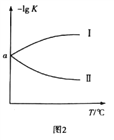
��a=_____________��
��ͼ2�з������������Ϊ_____________(������������)��