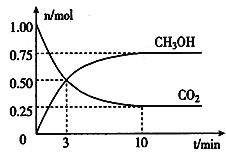
题目内容
【题目】为探究金属的腐蚀情况,某同学将锌片和铜片置于浸有饱和食盐水和酚酞的滤纸上,并构成如图所示的装置。下列判断合理的是( )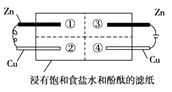
A.左边铜片上有气泡冒出
B.右边锌片上的反应为2Cl-- 2e-=Cl2↑
C.最先观察到红色的区域是②
D.两铜片质量均不发生变化
【答案】D
【解析】A、左边为原电池,Zn为负极,Cu为正极,铜上氧气得电子,所以没有气泡冒出,A不符合题意;
B、右边为电解池,Zn为阳极,锌片上的反应为Zn-2e-=Zn2+ , B不符合题意;
C、左边为原电池,右边为电解池,电解池中的反应速率快,所以最先观察到红色的区城是④,C不符合题意;
D、左右两边Cu片均不参加反应,所以Cu片质量均不发生变化,D符合题意;
所以答案是:D

 名校课堂系列答案
名校课堂系列答案【题目】用金属钴板(含少量Fe、Ni)制备应用广泛的氯化钴的工艺流程如下:
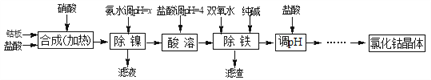
注:钴与盐酸反应极慢,需加入催化剂硝酸才可能进行实际生产。
有关钴、镍和铁化合物的性质见下表:
化学式 | 沉淀完全时的pH | 钴镍性质 |
Co(OH)2 | 9.4 | Co+2HCl=CoCl2+H2↑ Co2++2NH3·H2O=Co(OH)2↓+2NH4+ Co2++2H2O Ni+2HCl=NiCl2+H2↑ Ni2++6NH3·H2O=[Ni(NH3)6]2++6H2O |
Fe(OH)2 | 9.6 | |
Fe (OH)3 | 3.7 |
(1)“除镍”步骤中,NH3·H2O用量对反应收率的影响见表中数据:从表中数据可知,当PH调节至x=_______时,除镍效果最好。
加NH3·H2O调pH | 收率/% | Ni2+含量/% |
9 | 98.1 | 0.08 |
9.5 | 98 | 0.05 |
10 | 97.6 | 0.005 |
10.3 | 94 | 0.005 |
(2)“除镍”步骤必须控制在一定的时间内完成,否则沉淀中将有部分Co(OH)2转化为Co(OH)3,此反应的化学方程式为________________。
(3)“除铁”步骤中加入双氧水发生反应的离子方程式是________________________。
(4)“除铁”步骤中加入的纯碱作用是_______________________________。
(5)在“调pH”步骤中,加盐酸的作用是______________________________。
(6)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O![]() Fe(OH)3+3H+的平衡常数为_____________________。
Fe(OH)3+3H+的平衡常数为_____________________。
【题目】亚硝酰氯(ClNO)是有机合成中常用的试剂。
巳知:①2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g)△H1=akJ·mol-1
NaNO3(s)+ClNO(g)△H1=akJ·mol-1
②4NO2(8)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)△H2=bkJ·mol-1
2NaNO3(s)+2NO(g)+Cl2(g)△H2=bkJ·mol-1
③2NO(g)+Cl2(g)![]() 2ClNO(g)△H3=ckJ·mol-1
2ClNO(g)△H3=ckJ·mol-1
(1)上述反应中,a、b、c之间满足的关系为_____________________。
(2)某温度下,在密闭容器中发生反应:2NO(g)+Cl2(g)![]() 2ClNO(g),正反应速率表达式为v正=k·cn(NO)·cm(Cl2)(k是反应速率常数,只与温度有关;n、m为反应级数,只取正数)。测得正反应速率与浓度的关系如下表所示:
2ClNO(g),正反应速率表达式为v正=k·cn(NO)·cm(Cl2)(k是反应速率常数,只与温度有关;n、m为反应级数,只取正数)。测得正反应速率与浓度的关系如下表所示:
序号 | c(NO)/mol·L-1 | c(Cl2)/mol·L-1 | v正/mol·L-1·min-1 |
ⅰ | 0.100 | 0.100 | 0.144 |
ⅱ | 0.100 | 0.200 | 0.288 |
ⅲ | 0.200 | 0.100 | 0.576 |
①n=_____________,m=_____________。
②反应达到平衡后,其他条件不变时,缩小容器体积瞬间,v正_____________v逆(填“>"“<”或“=")。NO的平衡转化率_____________(填“增大”“减小”或“不变”)。
(3)在2L恒容密闭容器中充入0.8molClNO(g),发生反应:2ClNO(g)![]() Cl2(g)+2NO(g) △H,测得c(Cl2)与温度和时间的关系如图1所示。300℃时达到平衡后,温度与平衡常数负对数(-lgK)的关系如图2所示。
Cl2(g)+2NO(g) △H,测得c(Cl2)与温度和时间的关系如图1所示。300℃时达到平衡后,温度与平衡常数负对数(-lgK)的关系如图2所示。
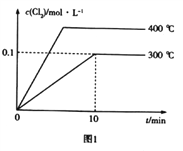
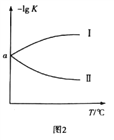
①a=_____________。
②图2中符合题意的曲线为_____________(填“Ⅰ”或“Ⅱ”)。