题目内容
5.某地有甲、乙两工厂排放污水,污水中各存在下列8种离子中的4种(两厂不含大量相同的离子):Ba2+、Fe3+、OH-、SO42-、Ag+、NO3-、Cl-、Na+,两厂的污水单独排放都会造成严重的水污染,若将两厂的污水按一定比例混合,沉淀后污水便只含硝酸钠而变得无色澄清,污染程度大大降低,关于污染源的分析,你认为正确的是( )| A. | SO42-和NO3-可能来自同一工厂 | B. | Cl-和NO3-一定不在同一工厂 | ||
| C. | Ag+和Na+可能来自同一工厂 | D. | Na+和NO3-来自同一工厂 |
分析 将两厂的污水按一定比例混合,沉淀后污水便能变得无色澄清,说明甲乙两厂的废水能反应生成沉淀,从离子能否大量共存的角度分析,可假设甲厂含有Ag+,则一定不含SO42-、OH-、Cl-,则SO42-、OH-、Cl-应存在与乙厂,因Ba2+与SO42-、Fe3+与OH-不能共存,则Fe3+、Ba2+存在于甲厂,根据溶液呈电中性可知,甲厂一定存在NO3-;所以甲厂含有的离子有:Ag+、Ba2+、Fe3+、NO3-,乙厂含有的离子为:Na+、Cl-、SO42-、OH-,以此解答该题.
解答 解:假设甲厂排放的污水中含有Ag+,根据离子共存,甲厂一定不含SO42-、OH-、Cl-,则SO42-、OH-、Cl-应存在与乙厂;
因Ba2+与SO42-、Fe3+与OH-不能共存,则Fe3+、Ba2+存在于甲厂,根据溶液呈电中性可知,甲厂一定存在阴离子NO3-;
所以甲厂含有的离子有:Ag+、Ba2+、Fe3+、NO3-,乙厂含有的离子为:Na+、Cl-、SO42-、OH-,
A.根据以上分析可知,SO42-离子和NO3-不可能来自同一工厂,故A错误;
B.根据分析可知,Cl-和NO3-一定来自不同工厂,故B正确;
C.Ag+和Na+一定来自不同工厂,故C错误;
D.由分析可知,Na+和NO3-一定来自不同的工厂,故D错误;
故选B.
点评 本题考查离子共存的判断,题目难度中等,注意掌握离子反应发生条件,能够根据离子反应条件判断离子是否能够共存,正确理解题干信息为解答本题的关键.

练习册系列答案
相关题目
15.下列物质既含有离子键,又含有共价键的是( )
| A. | C2H4 | B. | NaOH | C. | MgCl2 | D. | HCl |
20.下列气体溶解于水,没有发生氧化还原反应的是( )
| A. | SO2溶解于水 | B. | NO2溶解于水 | C. | CO2溶解于水 | D. | Cl2溶解于水 |
17.标准状况下相同质量的下列气体体积最大的是( )
| A. | O2 | B. | Cl2 | C. | N2 | D. | CO2 |
15.下列能表示化学反应速率的单位的是( )
| A. | mol/L | B. | mol/S | C. | mol/L•S | D. | mol/(L•min) |
16.下列叙述正确的是( )
| A. | 分子式为C3H6有机物最多存在4个C-C单键,与C5H12的碳碳单键数相同 | |
| B. | 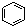 和 和  均是芳香烃, 均是芳香烃, 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 | |
| C. | 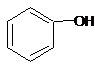 和 和 分子组成相差一个-CH2-,因此是同系物 分子组成相差一个-CH2-,因此是同系物 | |
| D. | 分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此推测可能有H-O键 |