题目内容
10.现有一份NaOH固体样品,里面混有少量的Na2CO3、NaCl杂质,某同学用中和滴定的方法来测定NaOH的纯度.其操作如下:①称取ag样品放入锥形瓶中,加水,震荡,使固体充分溶解.
②向该溶液中加入足量的BaCl2溶液,使CO32-沉淀完全.
③向所得混合液中滴加2~3滴酚酞指示剂,然后用c mol/L
④当反应达到终点时,测的消耗盐酸体积为V mL.
⑤计算样品的纯度.
试回答下面的问题:
(1)滴定终点时溶液颜色如何变化:滴入最后一滴盐酸溶液红色恰好退去且半分钟不变化.
(2)第②步中生成的BaCO3沉淀未过滤出来就直接用盐酸滴定,是否会对NaOH的含量测定造成影响(填“是”或“否”)否,理由是用酚酞作指示剂,从滴定开始到滴定终止,溶液始终呈碱性,故BaCO3沉淀不溶解,滴入盐酸只与NaOH反应.
(3)第②步中生成的BaCO3沉淀未过滤出来就直接用盐酸滴定,能否改用甲基橙作指示剂(填“是”或“否”)否,理由是甲基橙变色的pH范围为3.1-4.4,若改用甲基橙作指示剂,滴定至终点时,溶液呈酸性,BaCO3溶解,消耗的盐酸偏多.
分析 一份NaOH固体样品,里面混有少量的Na2CO3、NaCl杂质,向该溶液中加入足量的BaCl2溶液,使CO32-沉淀完全生成BaSO4,向所得混合液中滴加2~3滴酚酞指示剂,然后用c mol/L,当反应达到终点时,测的消耗盐酸体积为V mL,计算氢氧化钠物质的量,得到氢氧化钠样品的纯度,
(1)滴入酚酞的混合溶液呈碱性,溶液为红色,滴入盐酸反应到终点,滴入最后一滴盐酸溶液红色恰好退去且半分钟不变化,证明反应达到终点;
(2)盐酸和碳酸钡反应是酸性条件,根据酚酞的变色范围是8~10,溶液显弱碱性,此时BaCO3不溶解分析;
(3)甲基橙变色的pH范围为3.1-4.4,酸性条件下碳酸钡会溶解;
解答 解:(1)混合溶液中为氢氧化钠和氯化钠溶液呈碱性,滴入酚酞溶液为红色,滴入盐酸反应到终点,滴入最后一滴盐酸溶液红色恰好退去且半分钟不变化,证明反应达到终点;
故答案为:滴入最后一滴盐酸溶液红色恰好退去且半分钟不变化;
(2)酚酞的变色范围是8~10,溶液显弱碱性,此时BaCO3不溶解,所以向混有BaCO3沉淀的NaOH溶液中滴加盐酸,不会使BaCO3溶解从而能测定NaOH的含量;
故答案为:否,用酚酞作指示剂,从滴定开始到滴定终止,溶液始终呈碱性,故BaCO3沉淀不溶解,滴入盐酸只与NaOH反应;
(3)甲基橙变色的pH范围为3.1-4.4,若改用甲基橙作指示剂,滴定至终点时,溶液呈酸性,BaCO3溶解,消耗的盐酸偏多,故检测的结果偏高,所以不能用甲基橙作指示剂;
故答案为:否,甲基橙变色的pH范围为3.1-4.4,若改用甲基橙作指示剂,滴定至终点时,溶液呈酸性,BaCO3溶解,消耗的盐酸偏多;
点评 本题考查中和滴定,明确滴定实验数据处理及中和滴定的误差分析是解答本题的关键,注意酸碱中和的实质,题目难度中等.

 黄冈创优卷系列答案
黄冈创优卷系列答案| A. | SO42-和NO3-可能来自同一工厂 | B. | Cl-和NO3-一定不在同一工厂 | ||
| C. | Ag+和Na+可能来自同一工厂 | D. | Na+和NO3-来自同一工厂 |
| A. | Ag+,SO42-,NO3-,K+ | B. | Na+,HCO3-,Ba2+,NO3- | ||
| C. | Cl-,CO32-,Na+,Ca2+ | D. | Mg2+,SO42-,Na+,Cl- |
| A. | 甲烷和乙烷 | B. | CH4与CH3-CH2-CH3 | ||
| C. | CH3-CH2-CH2-CH3 与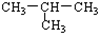 | D. | 苯与环己烷 |

| A. | 它的分子式为C8H10 | B. | 与苯乙烯是同分异构体 | ||
| C. | 能发生加成反应 | D. | 它的二氯代物共有4种 |
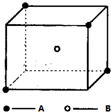 某离子晶体晶胞结构如图所示,A位于立方体的顶点,B位于立方体中心.试分析:
某离子晶体晶胞结构如图所示,A位于立方体的顶点,B位于立方体中心.试分析: