题目内容
一瓶久置的Na2SO3(杂质只有Na2SO4),为了测定其纯度,取样品5.0g配成100mL溶液,取其中25.00mL于锥形瓶中,用0.10mol?L-1酸性KMnO4溶液进行滴定,到终点时消耗KMnO4溶液20.00mL.求此样品的纯度.
考点:化学方程式的有关计算
专题:计算题
分析:发生反应:5SO32-+2MnO4-+6H+═5SO42-+2Mn2++3H2O,根据n=cV计算20mL样品溶液消耗n(KMnO4),进而计算100mL样品溶液消耗n(KMnO4),再根据方程式计算n(Na2SO3),根据m=nM计算m(Na2SO3),进而计算样品的纯度.
解答:
解:20mL样品溶液消耗n(KMnO4)=0.020L×0.1mol/L=0.002mol,
则100mL样品溶液消耗n(KMnO4)=0.002mol×
=0.008mol,
5SO32-+2MnO4-+6H+═5SO42-+2Mn2++3H2O
5 2
n(SO32-) 0.01mol
n(SO32-)=
=0.02mol
故n(Na2SO3)=n(SO32-)=0.02mol,
故样品纯度=
×100%=50.4%
答:此样品的纯度为50.4%.
则100mL样品溶液消耗n(KMnO4)=0.002mol×
| 100mL |
| 25mL |
5SO32-+2MnO4-+6H+═5SO42-+2Mn2++3H2O
5 2
n(SO32-) 0.01mol
n(SO32-)=
| 0.008mol×5 |
| 2 |
故n(Na2SO3)=n(SO32-)=0.02mol,
故样品纯度=
| 0.02mol×126g/mol |
| 5g |
答:此样品的纯度为50.4%.
点评:本题考查氧化还原反应滴定、化学方程式有关计算,正确书写方程式是关键,可以利用电子转移守恒计算,题目难度中等.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
某原电池的结构如图所示,下列有关该原电池的说法正确的是( )
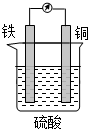

| A、该电池工作时电能转变为化学能 |
| B、铜片的质量增加 |
| C、H+向铁片移动 |
| D、铁片上发生的反应是Fe-2e-═Fe2+ |
下列说法不正确的是( )
| A、漂白粉长时间露置空气中会变质失效 |
| B、澄清石灰水可用来鉴别Na2CO3和NaHCO3溶液 |
| C、高温下SiO2能与Na2CO3反应放出CO2,但不能说明H2SiO3的酸性强于H2CO3 |
| D、金属的化学腐蚀和电化学腐蚀的本质相同,但电化学腐蚀伴有电流产生 |