题目内容
某校研究性学习小组同学在实验时把SO2通入装有1mol/L BaCl2溶液的试管中,出现了白色浑浊物.
(1)实验小组的同学根据沉淀溶解平衡原理查阅了工具书上的相关数据,经过计算推导得出:常温下即使把SO2通入1mol/L BaCl2溶液中至饱和,也不可能生成BaSO3沉淀,故白色浑浊物只能是BaSO4.你认为所查阅的数据为: .
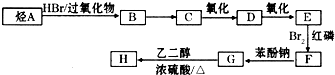
(2)二氧化硫通入氯化钡溶液中理论上不产生沉淀,而实际受到空气和溶液中氧气的影响很快便能观察到沉淀现象.为了避免产生沉淀,某化学小组设计了如图实验装置,实验操作步骤如下:

①气密性检查完好后,在装置A中的多孔隔板上放上锌粒,通过 注入稀硫酸.打开活塞,将产生的氢气导入到后续装置.
②D中气泡均匀冒出并验纯后关闭活塞,将装置D的导管插入烧杯中.
③通过装置B的 滴加浓硫酸,产生的气体进入到BaCl2溶液中,溶液保持澄清.
④打开活塞,将产生的氢气导入后续装置一段时间.
⑤将盛有BaCl2溶液的试管从装置中取出,拔去橡皮塞用胶头滴管伸入到苯层下方滴加双氧水,随即出现白色浑浊,滴加稀盐酸并振荡,白色浑浊不消失.
⑥拆卸装置,清洗仪器,处理剩余药品.
请回答下列问题
(2)实验步骤①和③的空白处使用的仪器名称分别为 、 ;
(3)反应开始前,先向制取SO2的装置中通入纯净的A中产生的氢气,其作用是: .
(4)装置C中苯的作用是 .
(5)装置D的目的是
(6)写出实验步骤⑤试管中发生反应的化学方程式 、 .
(1)实验小组的同学根据沉淀溶解平衡原理查阅了工具书上的相关数据,经过计算推导得出:常温下即使把SO2通入1mol/L BaCl2溶液中至饱和,也不可能生成BaSO3沉淀,故白色浑浊物只能是BaSO4.你认为所查阅的数据为:
(2)二氧化硫通入氯化钡溶液中理论上不产生沉淀,而实际受到空气和溶液中氧气的影响很快便能观察到沉淀现象.为了避免产生沉淀,某化学小组设计了如图实验装置,实验操作步骤如下:

①气密性检查完好后,在装置A中的多孔隔板上放上锌粒,通过
②D中气泡均匀冒出并验纯后关闭活塞,将装置D的导管插入烧杯中.
③通过装置B的
④打开活塞,将产生的氢气导入后续装置一段时间.
⑤将盛有BaCl2溶液的试管从装置中取出,拔去橡皮塞用胶头滴管伸入到苯层下方滴加双氧水,随即出现白色浑浊,滴加稀盐酸并振荡,白色浑浊不消失.
⑥拆卸装置,清洗仪器,处理剩余药品.
请回答下列问题
(2)实验步骤①和③的空白处使用的仪器名称分别为
(3)反应开始前,先向制取SO2的装置中通入纯净的A中产生的氢气,其作用是:
(4)装置C中苯的作用是
(5)装置D的目的是
(6)写出实验步骤⑤试管中发生反应的化学方程式
考点:性质实验方案的设计,二氧化硫的化学性质
专题:实验探究和数据处理题
分析:(1)能够生成BaSO3沉淀,需要查阅SO2饱和溶液中各离子的浓度;
(2)可以通过长颈漏斗实现锌粒和酸的接触,分液漏斗的结构和长颈漏斗有很大异,分液漏斗有盖有旋塞,长颈漏斗都没有;
(3)A装置获取氢气的作用是赶出装置中的气体,防止二氧化硫通入氯化钡溶液后的现象受到空气和溶液中氧气的影响;
(4)苯密度比水小,在氯化钡溶液的上层,可以起到隔离空气的作用;
(5)二氧化硫有毒,为了防止造成污染,在实验结束时要再次打开活塞,将产生的氢气导入后续装置一段时间,让SO2全部被氢氧化钠吸收以防止污染;
(6)双氧水具有氧化性,可以将二氧化硫氧化为硫酸,进而和氯化钡反应生成沉淀.
(2)可以通过长颈漏斗实现锌粒和酸的接触,分液漏斗的结构和长颈漏斗有很大异,分液漏斗有盖有旋塞,长颈漏斗都没有;
(3)A装置获取氢气的作用是赶出装置中的气体,防止二氧化硫通入氯化钡溶液后的现象受到空气和溶液中氧气的影响;
(4)苯密度比水小,在氯化钡溶液的上层,可以起到隔离空气的作用;
(5)二氧化硫有毒,为了防止造成污染,在实验结束时要再次打开活塞,将产生的氢气导入后续装置一段时间,让SO2全部被氢氧化钠吸收以防止污染;
(6)双氧水具有氧化性,可以将二氧化硫氧化为硫酸,进而和氯化钡反应生成沉淀.
解答:
解:(1)不可能生成BaSO3沉淀,故白色浑浊物只能是BaSO4,所查阅的数据为SO2饱和溶液中各离子的浓度、(SO2的溶解度、亚硫酸的电离平衡常数)以及 BaSO3的溶度积常数(BaSO3的溶解度或Ksp(BaSO3)等),故答案为:SO2饱和溶液中各离子的浓度;
(2)为防止气体逸出,利用长颈漏斗实现锌粒和酸的接触,利用B中分液漏斗滴加酸,故答案为:长颈漏斗;分液漏斗;
(3)反应开始前,先向制取SO2的装置中通入纯净的A中产生的氢气,目的为赶出装置中的空气防止H2SO3被氧化,故答案为:赶出装置中的空气防止H2SO3被氧化;
(4)装置C中苯的作用是将BaCl2溶液与空气隔离,防止H2SO3被氧化,故答案为:将BaCl2溶液与空气隔离,防止H2SO3被氧化;
(5)装置D为尾气处理装置,其目的为除去SO2防止污染空气,故答案为:除去SO2防止污染空气;
(6)双氧水具有氧化性,可以将二氧化硫氧化为硫酸,进而和氯化钡反应生成沉淀,发生的反应为SO2+H2O2=H2SO4(或H2SO3+H2O2=H2SO4+H2O)、H2SO4+BaCl2=BaSO4↓+2HCl,故答案为:SO2+H2O2=H2SO4;H2SO4+BaCl2=BaSO4↓+2HCl.
(2)为防止气体逸出,利用长颈漏斗实现锌粒和酸的接触,利用B中分液漏斗滴加酸,故答案为:长颈漏斗;分液漏斗;
(3)反应开始前,先向制取SO2的装置中通入纯净的A中产生的氢气,目的为赶出装置中的空气防止H2SO3被氧化,故答案为:赶出装置中的空气防止H2SO3被氧化;
(4)装置C中苯的作用是将BaCl2溶液与空气隔离,防止H2SO3被氧化,故答案为:将BaCl2溶液与空气隔离,防止H2SO3被氧化;
(5)装置D为尾气处理装置,其目的为除去SO2防止污染空气,故答案为:除去SO2防止污染空气;
(6)双氧水具有氧化性,可以将二氧化硫氧化为硫酸,进而和氯化钡反应生成沉淀,发生的反应为SO2+H2O2=H2SO4(或H2SO3+H2O2=H2SO4+H2O)、H2SO4+BaCl2=BaSO4↓+2HCl,故答案为:SO2+H2O2=H2SO4;H2SO4+BaCl2=BaSO4↓+2HCl.
点评:本题考查性质实验方案的设计及二氧化硫的性质,为高频考点,注意装置的作用及防止亚硫酸被氧化为实验设计的关键点,侧重分析与实验能力的综合考查,题目难度中等.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
下列各组离子在给定条件下能大量共存的是( )
| A、能使pH试纸呈红色的溶液:Na+、NH4+、Cl-、NO3- |
| B、滴入KSCN溶液显血红色的溶液:K+、Na+、CO32-、I- |
| C、能与铝反应产生H2的溶液:K+、Fe2+、Cl-、NO3- |
| D、常温下由水电离出的c(H+)=1×10-13mol/L的溶液:HCO3-、K+、SO42-、Cl- |
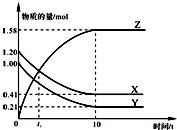 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )| A、反应开始到10 s,用Z表示的反应速率为0.158 mol/(L?s) |
| B、反应开始到10 s时,Y的转化率为79.0% |
| C、t1时,Z和X的浓度相等,达到了化学平衡状态 |
| D、反应的化学方程式为:X(g)+Y(g)?Z(g) |
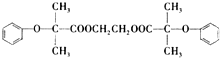 )可由下列路线合成:
)可由下列路线合成: