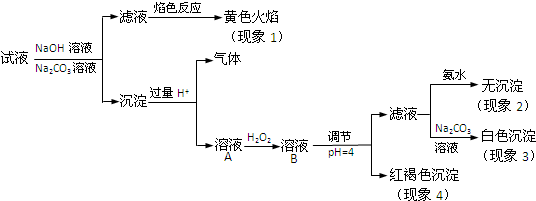
题目内容
5.A、B、C、D为中学化学中常见的四种气体单质.(1)已知在空气中A约21%、C约78% (均为体积分数);D在标准状况下的密度为3.170g/L.分别写出A、C、D的化学式:AO2、CN2、DCl2.SO2通入D的水溶液中,可以发生氧化还原反应,其化学方程式为:SO2+Cl2+2H2O=2HCl+H2SO4.
(2)在一定条件下B与A、C、D化合分别生成甲、乙、丙.已知甲、乙分子中含有的电子数均与Na+相同;乙与丙可化合生成一种离子化合物.甲、乙的化学式是:甲H2O、乙NH3;丙的电子式是:
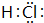 .
.(3)乙可以发生如下所示一系列转化(无关物质及反应条件已略)乙$\stackrel{A}{→}$X$\stackrel{A}{→}$Y$\stackrel{甲}{→}$Z.单质A与化合物乙反应的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.Z的稀溶液与过量铁粉反应,当反应中有1.806×1024个电子转移时,被还原的Z物质的量是1mol.
(4)将单质B、C按体积比为3:1混合分别装入盛有催化剂的密闭容器Ⅰ和Ⅱ中(容积相同),若反应过程中容器Ⅰ保持温度和压强不变,容器Ⅱ保持温度和容积不变,当反应达平衡时,容器Ⅰ内气体的密度大于容器Ⅱ的密度(填“大于”、“小于”或“等于”),理由是:该反应是气体总物质的量减小的反应,总质量不变,若保持温度和容积不变,混合气体密度不变.若保持温度和压强不变,混合气体的体积变小,密度增大.在容器Ⅰ中,当反应达平衡时,容积变为起始时的$\frac{7}{8}$,则C的转化率为25%.
分析 (1)已知在空气中A约21%、C约78% (均为体积分数),则A为O2、C为N2,D在标准状况下的密度为3.170g/L,相对分子质量为3.17×22.4=71,则D为Cl2;
(2)在一定条件下B与A、C、D化合分别生成甲、乙、丙.已知甲、乙分子中含有的电子数均与Na+相同;乙与丙可化合生成一种离子化合物,则B为H2,甲为H2O、乙为NH3,丙为HCl;
(3)乙可以发生如下所示一系列转化:乙$\stackrel{A}{→}$X$\stackrel{A}{→}$Y$\stackrel{甲}{→}$Z,则X为NO、Y为NO3、Z为HNO3,Z的稀溶液与过量铁粉发生反应:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O;
(4)发生反应:N2+3H2?2NH3,该反应是气体物质的量减小的反应,总质量不变,若保持温度和容积不变,混合气体密度不变.若保持温度和压强不变,混合气体的体积变小,密度增大;
设氢气、氮气物质的量分别为3mol、1mol,在容器Ⅰ中,当反应达平衡时,容积变为起始时的$\frac{7}{8}$,则此时混合物气体物质的量为起始的$\frac{7}{8}$,由方程式可知1mol氮气反应时总物质的量减少2mol,计算参加反应氮气物质的量,进而计算氮气转化率.
解答 解:(1)已知在空气中A约21%、C约78% (均为体积分数),则A为O2、C为N2,D在标准状况下的密度为3.170g/L,相对分子质量为3.17×22.4=71,则D为Cl2,SO2通入Cl2的水溶液中,可以发生氧化还原反应,其化学方程式为:SO2+Cl2+2H2O=2HCl+H2SO4,
故答案为:O2;N2;Cl2;SO2+Cl2+2H2O=2HCl+H2SO4;
(2)在一定条件下B与A、C、D化合分别生成甲、乙、丙.已知甲、乙分子中含有的电子数均与Na+相同;乙与丙可化合生成一种离子化合物,则B为H2,甲为H2O、乙为NH3,丙为HCl,丙的电子式是: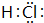 ,
,
故答案为:H2O;NH3;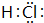 ;
;
(3)乙可以发生如下所示一系列转化:乙$\stackrel{A}{→}$X$\stackrel{A}{→}$Y$\stackrel{甲}{→}$Z,则X为NO、Y为NO3、Z为HNO3,单质A与化合物乙反应的化学方程式:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,Z的稀溶液与过量铁粉发生反应:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,当反应中有1.806×1024个电子转移时,即转移电子为3mol,被还原的硝酸生成NO,由N元素守恒可知被还原的硝酸为$\frac{3mol}{5-2}$=1mol
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;1;
(4)发生反应:N2+3H2?2NH3,该反应是气体总物质的量减小的反应,总质量不变,若保持温度和容积不变,混合气体密度不变.若保持温度和压强不变,混合气体的体积变小,密度增大,故当反应达平衡时,容器Ⅰ内气体的密度大于容器Ⅱ的密度;
设氢气、氮气物质的量分别为3mol、1mol,在容器Ⅰ中,当反应达平衡时,容积变为起始时的$\frac{7}{8}$,则此时混合物气体物质的量为起始的$\frac{7}{8}$,平衡时混合气体总物质的量为(3+1)mol×$\frac{7}{8}$=3.5mol,由方程式可知1mol氮气反应时总物质的量减少2mol,则参加反应氮气物质的量为$\frac{1mol}{2mol}$×(4-3.5)mol=0.25mol,故氮气转化率为$\frac{0.25mol}{1mol}$×1005=25%,
故答案为:大于;该反应是气体总物质的量减小的反应,总质量不变,若保持温度和容积不变,混合气体密度不变.若保持温度和压强不变,混合气体的体积变小,密度增大;25%.
点评 本题考查无机物推断,需要学生熟练掌握元素化合物知识,是对学生综合能力的考查,难度中等.

| A. | FeCl2 | B. | Al2S3 | C. | CuCl2 | D. | Mg3N2 |
| A. | 12C与14C互为同素异形体 | |
| B. | 14C的原子中有6个质子,8个电子 | |
| C. | 12C与14C的原子中含有的中子数之比为3:4 | |
| D. | 金刚石与C60都属于原子晶体 |
| A. | 强酸强碱盐 | B. | 强酸弱碱盐 | ||
| C. | 强碱弱酸盐 | D. | 上述三种盐均可能 |
| A. | 由H原子形成1molH-H键要吸收热量 | |
| B. | C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol,则可判定金刚石比石墨稳定 | |
| C. | 500℃、30 MPa下,0.5 mol N2(g)和1.5 mol H2(g)反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | 已知Ni(CO)4(s)=Ni(s)+4CO(g)△H=Q kJ•mol-1,则Ni(s)+4CO(g)=Ni(CO)4(s)△H=-Q kJ•mol-1 |
| A. | H3O和OH-中具有相同的质子数和电子数 | |
| B. | 中子数为20的氯原子可表示为${\;}_{17}^{20}$Cl | |
| C. | 23592U 和23892U 是同位素,物理性质几乎相同,化学性质不同 | |
| D. | S2-的结构示意图 |
| A. | 在地球上分布很广,淡水资源取之不尽,用之不竭 | |
| B. | 大气中二氧化碳含量的增多是造成“温室效应”的主要原因 | |
| C. | 某广告语:本饮料纯属天然物质,不含任何化学成分 | |
| D. | 到城乡结合处燃放鞭炮,可避免污染环境 |
| A. | 强电解质溶液一定比弱电解质溶液导电能力强 | |
| B. | BaSO4是弱电解质 | |
| C. | 酒精、CO2是非电解质 | |
| D. | 盐酸能导电,所以盐酸是电解质 |