题目内容
20.已知一种c(H+)=1×10-3 mol/L的一元酸溶液和一种c(OH-)=1×10-3mol/L的一元碱溶液等体积混合后溶液呈碱性,生成的盐可能是( )| A. | 强酸强碱盐 | B. | 强酸弱碱盐 | ||
| C. | 强碱弱酸盐 | D. | 上述三种盐均可能 |
分析 c(H+)=1×10-3 mol/L的一元酸溶液和一种c(OH-)=1×10-3mol/L的一元碱溶液等体积混合后溶液呈碱性,说明碱有剩余,可能是碱部分电离而酸完全电离,所以可能是碱为弱碱、酸为强酸,据此分析解答.
解答 解:c(H+)=1×10-3 mol/L的一元酸溶液和一种c(OH-)=1×10-3mol/L的一元碱溶液等体积混合后溶液呈碱性,说明碱有剩余,可能是碱部分电离而酸完全电离,所以可能是碱为弱碱、酸为强酸,则生成的盐可能是强酸弱碱盐,故选B.
点评 本题考查酸碱混合溶液定性判断,为高频考点,明确酸碱相对强弱与其盐溶液酸碱性关系是解本题关键,题目难度不大.

练习册系列答案
相关题目
10.在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
下列说法错误的是( )
| 物质 | X | Y | Z |
| 初始浓度(mol•L-1) | 0.1 | 0.2 | 0 |
| 平衡浓度(mol•L-1) | 0.05 | 0.05 | 0.1 |
| A. | 反应达平衡时,X的转化率为50% | |
| B. | 反应可表示为:X+3Y?2Z,其平衡常数为1600 | |
| C. | 增大压强使平衡向生成Z的方向移动,平衡常数增大 | |
| D. | 当混合气体的平均相对分子质量不变时,该反应达到了化学平衡状态 |
11.为达到下列实验目的,所采用的方法合理的是( )
| A. | 溴水中提取溴:分液 | |
| B. | 分离水和汽油的混合物:蒸馏 | |
| C. | 分离饱和食盐水和沙子的混合物:过滤 | |
| D. | 从硝酸钾和氯化钠混合液中获取硝酸钾:萃取 |
8.下列离子方程式书写正确的是( )
| A. | 石灰乳与Na2CO3溶液混合:Ca2++C${O}_{3}^{2-}$═CaCO3↓ | |
| B. | NH4HSO3溶液与足量NaOH溶液混合加热: N${H}_{4}^{+}$+HS${O}_{3}^{-}$+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+S${O}_{3}^{2-}$+2H2O | |
| C. | 氨气通入醋酸溶液CH3COOH+NH3═CH3COONH4 | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++S${O}_{4}^{2-}$+H++OH-═BaSO4↓+H2O |
15.下列事实中,能用同一化学原理解释的是( )
| A. | 氯气和二氧化硫都能使品红溶液褪色 | |
| B. | 二氧化硫和乙烯都能使溴水溶液褪色 | |
| C. | 二氧化硫和乙烯都能使酸性高锰酸钾溶液褪色 | |
| D. | 大量Na2SO4和甲醛都能使蛋白质从溶液中析出 |
9.已知298K、101KPa条件下
2H2(g)+O2(g)=2H2O(g)△H1=-483.6kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1
据此判断,下列说法正确的是( )
2H2(g)+O2(g)=2H2O(g)△H1=-483.6kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1
据此判断,下列说法正确的是( )
| A. | H2(g)与O2(g)反应生成H2O(g)是吸热反应 | |
| B. | 1 molH2O(g)转变成1 molH2O(l)放出44.0kJ热量 | |
| C. | 1 molH2O(l)转变成1 molH2O(g)放出44.0kJ热量 | |
| D. | 1 molH2O(g)转变成1 molH2O(l)放出88.0kJ热量 |
10.将下列物质的量浓度相等的溶液等体积混合有白色沉淀生成,加入过量稀硝酸后,沉淀消失并放出气体,再加入AgNO3溶液又有白色沉淀生成的是( )
| A. | 碳酸钠与氢氧化钙 | B. | 碳酸钠与氯化钡 | ||
| C. | 碳酸氢钙与氢氧化钠 | D. | 硫酸钠与氯化钡 |
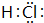 .
.