题目内容
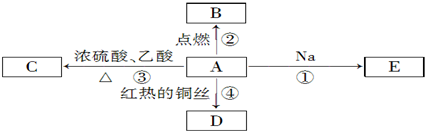
10.下列说法正确的是( )| A. | 由H原子形成1molH-H键要吸收热量 | |
| B. | C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol,则可判定金刚石比石墨稳定 | |
| C. | 500℃、30 MPa下,0.5 mol N2(g)和1.5 mol H2(g)反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | 已知Ni(CO)4(s)=Ni(s)+4CO(g)△H=Q kJ•mol-1,则Ni(s)+4CO(g)=Ni(CO)4(s)△H=-Q kJ•mol-1 |
分析 A、根据形成化学键要放出热量;
B、根据能量越低越稳定判断;
C、根据可逆反应的特点:反应物不能完全转化为产物来回答;
D、根据可逆反应,正逆反应的焓变数值相等,符合相反判断.
解答 解:A、因形成化学键要放出热量,故A错误;
B、因为C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol,则金刚石能量高,所以可判定石墨比金刚石稳定,故B错误;
C、根据可逆反应的特点:反应物不能完全转化为产物,0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,1mol N2和3molH2置于密闭的容器中完全反应生成NH3(g),放热大于38.6kJ,故C错误;
D、因可逆反应,正逆反应的焓变数值相等,符合相反,所以Ni(CO)4(s)=Ni(s)+4CO(g)△H=Q kJ•mol-1,则Ni(s)+4CO(g)=Ni(CO)4(s)△H=-Q kJ•mol-1,故D正确;
故选D.
点评 本题是一道涉及反应热和焓变知识的综合考查题,考查学生对基础知识的梳理和应用情况,难度中等.

练习册系列答案
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目
20.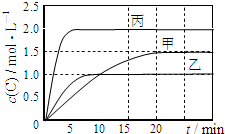 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以如表和如图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以如表和如图表示:
下列说法正确的是( )
 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以如表和如图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以如表和如图表示:| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
| A. | x=1 | |
| B. | 10min内乙容器中反应的平均速率v(B)=0.025mol•L-1•min-1 | |
| C. | 由图可知:T1<T2,且该反应为吸热反应 | |
| D. | T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为75% |
1.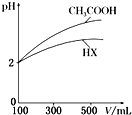 水是生命的源泉、工业的血液、城市的命脉.请回答下列问题:
水是生命的源泉、工业的血液、城市的命脉.请回答下列问题:
(1)纯水在25℃时,pH=7,该温度下1mol•L-1的NaOH溶液中,由水电离出的
c(OH-)=10-14mol•L-1.
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解方程式为C${O}_{3}^{2-}$+H2O?HC${O}_{3}^{-}$+OH-、HC${O}_{3}^{-}$+H2OH2CO3+OH-,由水电离出的c(OH-)=0.001mol•L-1.
(3)体积均为100mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如右图所示,则HX的电离常数小于(填“大于”“小于”或“等于”)CH3COOH的电离常数.理由是稀释相同倍数,一元酸HX的pH变化量比CH3COOH的小,故酸性较弱,电离常数较小.
(4)电离常数是衡量弱电解质电离程度强弱的物理量.已知:
25℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三溶液的pH由大到小的顺序为Na2CO3溶液>NaCN溶液>CH3COONa溶液.
 水是生命的源泉、工业的血液、城市的命脉.请回答下列问题:
水是生命的源泉、工业的血液、城市的命脉.请回答下列问题:(1)纯水在25℃时,pH=7,该温度下1mol•L-1的NaOH溶液中,由水电离出的
c(OH-)=10-14mol•L-1.
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解方程式为C${O}_{3}^{2-}$+H2O?HC${O}_{3}^{-}$+OH-、HC${O}_{3}^{-}$+H2OH2CO3+OH-,由水电离出的c(OH-)=0.001mol•L-1.
(3)体积均为100mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如右图所示,则HX的电离常数小于(填“大于”“小于”或“等于”)CH3COOH的电离常数.理由是稀释相同倍数,一元酸HX的pH变化量比CH3COOH的小,故酸性较弱,电离常数较小.
(4)电离常数是衡量弱电解质电离程度强弱的物理量.已知:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
18.在有催化剂存在的条件下,将2体积的SO2和1体积的O2混合装入密闭容器中并加热一段时间后,将混合气体通入BaCl2溶液中,产生的沉淀( )
| A. | 不可能是BaSO4 | B. | 一定是BaSO3 | ||
| C. | 一定是BaSO4 | D. | 一定是BaSO3和BaSO4 |
15.你认为下列数据可信的是( )
| A. | 某溶液中溶质的质量分数超过100% | B. | 某常见气体的密度为1.8g/cm3 | ||
| C. | 用10ml量筒量取5.23ml浓硫酸 | D. | 用托盘天平称得氯化钠 5.0g |
2.下列说法正确的是( )
| A. | 电解饱和食盐水可制得金属钠 | |
| B. | 通过化学反应从海水中可提取氯化钠、溴、碘等物质 | |
| C. | 为了增强高锰酸钾溶液的氧化性可用盐酸酸化 | |
| D. | ClO2是一种有刺激性气味的黄绿色气体,除用于杀菌消毒外,还广泛用于环保、漂白、除臭 等方面 |
 .
.