题目内容
15.下列说法正确的是( )| A. | 强电解质溶液一定比弱电解质溶液导电能力强 | |
| B. | BaSO4是弱电解质 | |
| C. | 酒精、CO2是非电解质 | |
| D. | 盐酸能导电,所以盐酸是电解质 |
分析 A.溶液的导电能力与溶液中离子浓度成正比,与电解质的强弱无关;
B.完全电离的电解质为强电解质;
C.在水溶液里或熔融状态下都不能导电的化合物为非电解质,该定义的前提必须是化合物;
D.电解质必须是化合物,盐酸是氯化氢的水溶液是混合物.
解答 解:A.溶液的导电能力与溶液中离子浓度成正比,与电解质的强弱无关,强电解质溶液的导电能力不一定比弱电解质溶液强,故A错误;
B.BaSO4在熔融情况下能够导电,其本质原因是BaSO4在熔融态时发生了电离,完全电离出自由移动的钡离子和硫酸根离子,属于强电解质,故B错误;
C.蔗糖(C12H22O11)在水溶液中只有分子,属于非电解质,CO2自身不能电离,属于非电解质,故C正确;
D.氯化氢在水溶液中,能完全电离,HCl=H++Cl-,是自身电离,是电解质,盐酸是氯化氢的水溶液是混合物,不是电解质,故D错误;
故选C.
点评 本题考查电解质、非电解质、强弱电解质概念的辨析,难度不大,解题时紧抓住电解质必须是化合物.

练习册系列答案
相关题目
6.以下关于混合物分离提纯操作或原理说法不正确的是( )
| A. | 实验室中用含有Ca2+、Mg2+、Cl-的自来水制取蒸馏水,可采用蒸馏的方法 | |
| B. | 用CCl4萃取碘水的实验中,振荡静置后,下层为紫红色溶液 | |
| C. | 利用植物油的密度比水小且不溶于水的原理,可用分液的方法分离这两种液体混合物 | |
| D. | 蒸馏时,温度计的水银球应充分接触溶液 |
3.下列离子方程式正确的是( )
| A. | 碳酸钙和盐酸反应:CaCO3+2H+═H2O+CO2↑+Ca2+ | |
| B. | 铜片插入硝酸银溶液:Cu+Ag+═Cu2++Ag | |
| C. | 溴水滴入碘化钾溶液:Br2+I-═Br-+I2 | |
| D. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
10.将下列物质的量浓度相等的溶液等体积混合有白色沉淀生成,加入过量稀硝酸后,沉淀消失并放出气体,再加入AgNO3溶液又有白色沉淀生成的是( )
| A. | 碳酸钠与氢氧化钙 | B. | 碳酸钠与氯化钡 | ||
| C. | 碳酸氢钙与氢氧化钠 | D. | 硫酸钠与氯化钡 |
7.下列离子方程式不正确的是( )
| A. | 在Ba(OH)2溶液中加入过量NaHCO3:Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O | |
| B. | 硝酸银溶液与铜:Cu+2Ag+=Cu2++2Ag | |
| C. | 标准状况下2.24LCO2通入1mol/L50mLCa(OH)2溶液中:CO2+OH-=HCO3- | |
| D. | 金属铝溶于稀硫酸溶液:Al+2H+=Al3++H2↑ |
4.下列说法正确的是( )
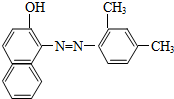

| A. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到,发生了化学反应 | |
| B. | 干馏煤可以得到苯和氨等重要化工原料 | |
| C. | 如图所示物质属于芳香烃 | |
| D. | 如图所示物质能被酸性高锰酸钾氧化 |
 .
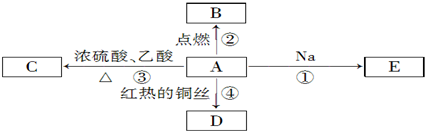
.
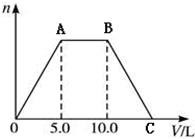 向NaOH和Ca(OH)2的混合溶液中不断地通入足量的CO2气体,生成的沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图,试回答:
向NaOH和Ca(OH)2的混合溶液中不断地通入足量的CO2气体,生成的沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图,试回答: