题目内容
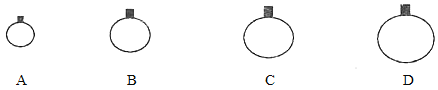
【题目】如图1是钠及其化合物与水反应关系图,两圆圈相交的部分表示圆圈内的物质相互发生的反应。请按要求填空。
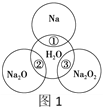
(1)反应①的化学方程式_____________。
(2)在反应②中的混合液滴入酚酞,可观察到的现象是____________。
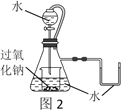
(3)研究性学习小组设计图2装置探究反应③是放热反应。
i.向烧杯内滴加水时,可观察到的现象是____________。
ⅱ.该反应的化学方程式为____________。
ⅲ.举例过氧化钠的用途______。(写一种)
(4)超氧化钾(KO2)与过氧化钠一样能吸收CO2生成碳酸盐及O2,写出该反应的化学方程式____________。
【答案】2Na+2H2O=2NaOH+H2↑ 混合液变红 烧杯中产生气泡,反应放热,锥形瓶内气体体积增大 2Na2O2+2H2O=4NaOH+O2↑ 供氧剂(或漂白剂) 4KO2+2CO2=2K2CO3+3O2
【解析】
(1)反应①是钠与水反应生成氢氧化钠和氢气;
(2)在反应②是氧化钠与水反应生成氢氧化钠,在混合液中滴入酚酞,酚酞遇碱变红;
(3)反应③过氧化钠与水反应生成氢氧化钠和氧气,是放热反应,图2装置中:i.向烧杯内滴加水时,反应产生氧气,故烧杯中产生气泡,反应放热,锥形瓶内气体体积增大,U形管内液体右移,静止后液面左边低于右边;ⅱ.该反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑;ⅲ.过氧化钠的用途有供氧剂、漂白剂等等;
(4)超氧化钾(KO2)与过氧化钠一样能吸收CO2生成碳酸盐及O2,发生反应的化学方程式为:4KO2+2CO2=2K2CO3+3O2。
(1)反应①是钠与水反应生成氢氧化钠和氢气,其化学方程式为:2Na+2H2O=2NaOH+H2↑;
(2)在反应②是氧化钠与水反应生成氢氧化钠,在混合液中滴入酚酞,酚酞遇碱变红,则可观察到的现象是:混合液变红;
(3)反应③过氧化钠与水反应生成氢氧化钠和氧气,是放热反应,图2装置中:i.向烧杯内滴加水时,反应产生氧气,故烧杯中产生气泡,反应放热,锥形瓶内气体体积增大,U形管内液体右移,静止后液面左边低于右边;ⅱ.该反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑;ⅲ.过氧化钠的用途有供氧剂、漂白剂等等;
(4)超氧化钾(KO2)与过氧化钠一样能吸收CO2生成碳酸盐及O2,发生反应的化学方程式为:4KO2+2CO2=2K2CO3+3O2。

 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案