题目内容
【题目】有一包白色固体粉末,已知除了含有 KNO3 以外,其中可能还含有 KCl、Ba(NO3)2、CuSO4、K2CO3、Na2SO4 中的一种或几种,现通过以下实验来确定该样品的组成:
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色;
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量 AgNO3 溶液,产生白色沉淀; 根据上述实验事实,回答下列问题:
(1)原白色粉末中除 KNO3 以外一定还含有的物质是_________,一定不含有的物质 是_____,可能存在的物质是_____(填化学式);
(2)请写出第②步变化中所涉及的化学反应方程式:_____;
(3)A 同学为了确认该固体粉末中“可能存在的物质”是否存在, 他重新取了少量该样品于试管中加适量的蒸馏水溶解,请根据该同学设计的方案填空:
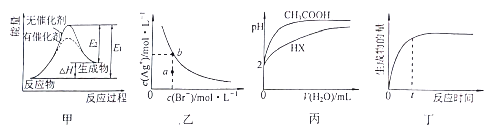
![]()
加入的试剂①_________试剂②_____(填化学式);当加入试剂②时,实验现 象为_____就可以确认该物质一定存在。
(4)B 同学为了进一步确定该样品的成份,他称取了 10.0 g 该固体,按如下方案进行实验: 说明:实验中产生的气体已经换算成标准状况下的体积。
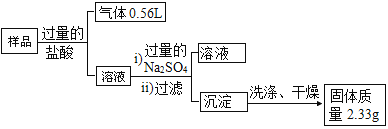
①请简述在实验室进行上述实验过程时如何洗涤沉淀_____。
②若按照 B 同学以上实验方案,还需对“溶液 2”中的溶质进一步分析,通过已有的实验数据分析,若该 样品中含 KNO3 的质量分数为_____时,可以确认样品中一定不含有“可能存在的物质”。
【答案】Ba(NO3)2、K2CO3 CuSO4、Na2SO4 KCl BaCO3 + 2HNO3 = Ba(NO3)2 + CO2↑ + H2O HNO3 AgNO3 有不溶于稀 HNO3 的白色沉淀产生 向过滤器中加入蒸馏水至完全浸没沉淀为止,待水自然滤干后,再重复操作 2 ~ 3 次 39.4%
【解析】
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色说明一定不含CuSO4、所以沉淀为碳酸钡或硫酸钡或两者都有,判断Ba(NO3)2一定存在,K2CO3、Na2SO4最少有一种;
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生,证明沉淀是BaCO3,则原固体含有K2CO3,不含Na2SO4;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生,证明白色沉淀为BaSO4;
④另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀,该沉淀可能是碳酸银或氯化银、或两者都有,不能确定是否含有Cl-,据此分析。
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色说明一定不含CuSO4、所以沉淀为碳酸钡或硫酸钡或两者都有,判断Ba(NO3)2一定存在,K2CO3、Na2SO4最少有一种;
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生,证明沉淀是BaCO3,则原固体含有K2CO3,不含Na2SO4;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生,证明白色沉淀为BaSO4;
④另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀,该沉淀可能是碳酸银或氯化银、或两者都有,不能确定是否含有Cl-。
综上所述:白色固体粉末一定含有KNO3、Ba(NO3)2、K2CO3;一定不含CuSO4、Na2SO4;可能含有KCl;
(1)原白色粉末中除 KNO3 以外一定还含有的物质是Ba(NO3)2、K2CO3,一定不含有的物质是CuSO4、Na2SO4;可能存在的物质是KCl;
(2)第②步变化中所涉及的化学反应是碳酸钡与稀硝酸反应生成硝酸钡、二氧化碳和水,反应的化学方程式为BaCO3 + 2HNO3 = Ba(NO3)2 + CO2↑ + H2O;
(3)A 同学为了确认该固体粉末中“可能存在的物质” KCl是否存在,检验氯化钾可选择硝酸和硝酸银进行检验,故加入的试剂①HNO3试剂②AgNO3;加入足量的稀硝酸酸化后,当加入试剂②时,实验现 象为有不溶于稀 HNO3 的白色沉淀产生就可以确认该物质一定存在;
(4)①在实验室进行上述实验过程时,洗涤沉淀的操作为:向过滤器中加入蒸馏水至完全浸没沉淀为止,待水自然滤干后,再重复操作 2 ~ 3 次;
②根据流程可知,产生气体的体积为0.56L,则产生二氧化碳的物质的量为![]() ,则碳酸钾的物质的量为0.025mol,质量为3.45g;沉淀的质量为2.33g,则为0.01mol硫酸钡,可知Ba(NO3)2的物质的量为0.01mol,质量为2.61g;若该 样品中不含有氯化钾,则 KNO3 的质量分数为
,则碳酸钾的物质的量为0.025mol,质量为3.45g;沉淀的质量为2.33g,则为0.01mol硫酸钡,可知Ba(NO3)2的物质的量为0.01mol,质量为2.61g;若该 样品中不含有氯化钾,则 KNO3 的质量分数为![]() ,故若该 样品中含 KNO3 的质量分数为39.4%时,可以确认样品中一定不含有“可能存在的物质”。
,故若该 样品中含 KNO3 的质量分数为39.4%时,可以确认样品中一定不含有“可能存在的物质”。