题目内容
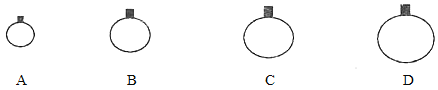
【题目】(1)常温常压下,用等质量的CH4、CO2、O2、SO2四种气体分别吹出四个气球,其中气体为SO2的是_____(填选项序号)。
(2)在标准状况下,2.24L由N2、N2O组成的混合气体中含有的氮元素的质量约为_______。
(3)在0.1L由KCl、K2SO4、ZnSO4形成的植物营养液中,c(K+)=0.7 mol·L1,c(Zn2+)=0.1 mol·L1,
c(Cl)=0.3mol·L1,向混合溶液中滴加足量的BaCl2溶液后产生沉淀的物质的量为_______。
(4)氯气(Cl2)、重铬酸钾(K2Cr2O7)是常用的氧化剂。
①硫代硫酸钠(Na2S2O3)被称为“养鱼宝”,可降低水中的氯气对鱼的危害。已知25.0mL0.100 mol·L1 Na2S2O3溶液恰好把标准状况下224mL的Cl2完全转化为Cl,则S2O32将转化成______。
A S2 B S C SO32 D SO42
②实验室可用K2Cr2O7固体与浓盐酸反应制备氯气,发生反应化学方程式为K2Cr2O7 + 14HCl(浓)=3Cl2↑ + 2CrCl3 +2KCl +7H2O,若反应中转移0.6mole,则被氧化HCl的物质的量为_______。
(5)在干燥烧瓶中用向下排空气法收集氨气,由于空气不可能排净(已知:空气的平均相对分子质量为29),所以瓶内气体对氢气的相对密度为9.5,将此瓶气体倒置于水槽中,烧瓶内液面上升的体积占烧瓶总体积的_______。
(6)100mL 0.3mol/L Na2SO4(密度为d1 g/cm3)和50mL 0.2mol/L Al2(SO4)3(密度为d2 g/cm3)混合,所得密度为d3 g/cm3的混合溶液中SO42-的浓度为___________。(用含d1,d2, d3的式子表示)
【答案】A 2.8g 0.03mol D 0.6mol ![]() (或83.3%)
(或83.3%) ![]() mol/L
mol/L
【解析】
(1)在相同条件下,气体的物质的量越多,气体的体积越大。由于四种气体的质量相等,所以根据n=m/M可知,气体的摩尔质量越大,物质的量越小,二氧化硫的摩尔质量最大,二氧化硫的物质的量最小,体积最小,答案选A,故答案为:A;
(2)在标准状况下,2.24L由N2、N2O组成的混合气体的物质的量是0.1mol,因为一个N2和N2O分子中都含有2个氮原子,所以不论N2和N2O的比例如何,只要物质的量是确定的,那么N的物质的量就是混合气体物质的量的2倍,2.24L由N2、N2O组成的混合气体中含有的氮元素的物质的量为0.2mol,质量为0.2mol×14g/mol=2.8g,故答案为:2.8g;
(3)由溶液呈电中性可知,溶液中硫酸根离子的浓度为:c(SO42-)=(0.7 mol·L1+0.1 mol·L1×2-0.7 mol·L1+0.1 mol·L1×2-0.3mol·L1)÷2=0.3mol·L1,则硫酸根离子的物质的量为:0.3mol·L1×0.1L=0.03mol,则向混合溶液中滴加足量的BaCl2溶液后产生硫酸钡沉淀的物质的量为0.03mol,故答案为:0.03mol;
(4)①标准状况下224mL(即0.01mol)Cl2完全转化为Cl-时,得电子总量是0.01mol×2×(1-0)=0.02mol,设S2O32-转化成的产物中,硫的化合价是x,则根据电子守恒:25.0mL0.1molL-1的Na2S2O3失电子数=0.025L×0.1molL-1×2×(x-2)=0.02,解得x=6,所以S2O32-转化成SO42,故答案为:D;
②依据反应方程式,消耗1mol K2Cr2O7转移电子6mol,若反应中转移0.6mole,则参加反应的HCl的物质的量为1.4mol,参加反应的HCl,只有其中的6个化合价由-1价→0价被氧化,则被氧化的HCl的物质的量为0.6mol,故答案为:0.6mol。
(5)用排气法收集氨气后,收集到的氨气气体不纯,含有空气;空气的平均相对分子质量为29,混合气体的平均相对分子质量为: 9.5×2=19;设烧瓶的容积为V L,氨气的体积为x L,空气的体积为(V-x)L,则有: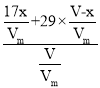 =19,解之得:x=
=19,解之得:x=![]() V;将此瓶气体倒置于水槽中,进入烧瓶的液体体积为氨气体积,即
V;将此瓶气体倒置于水槽中,进入烧瓶的液体体积为氨气体积,即![]() V,烧瓶内液面上升的体积占烧瓶总体积为:
V,烧瓶内液面上升的体积占烧瓶总体积为: ![]() =
=![]() (或83.3%);
(或83.3%);
故答案是:![]() (或83.3%);
(或83.3%);
(6)混合液的质量为(100d1+50d2)g,混合后溶液的体积为:![]() mL=
mL=![]() ×10-3L;溶液混合后n(SO42-)=(0.1×0.3×1+0.05×0.2×3)mol=0.06mol;根据c=
×10-3L;溶液混合后n(SO42-)=(0.1×0.3×1+0.05×0.2×3)mol=0.06mol;根据c=![]() 可知,混合溶液中SO42-的浓度为:
可知,混合溶液中SO42-的浓度为: =
=![]() mol/L=
mol/L=![]() mol/L
mol/L
故答案是:![]() mol/L。
mol/L。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案【题目】下列根据实验操作和现象所得出的结论不正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向NaHS溶液中滴入酚酞 | 溶液变红色 | HS-水解程度大于电离程度 |
B | 向浓度均为0.1mol/L的MgCl2、CuCl2混合溶液中逐滴加入氨水 | 出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
C | 向Na2CO3溶液中加入浓盐酸,将产生的气体通入硅酸钠溶液中 | 产生白色浑浊 | 酸性:盐酸>碳酸>硅酸 |
D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中存在I |
A. AB. BC. CD. D