题目内容
12.下列说法正确的是( )| A. | 浓硫酸能使蔗糖变黑,体现浓硫酸具有强酸化性 | |
| B. | 铵盐受热易分解,均有NH3产生 | |
| C. | 闪电时,N2转化为NO可以称为氮的固定 | |
| D. | 化工厂可通过加高烟囱排放废气,防止形成酸雨 |
分析 A.浓硫酸将有机物里的氢、氧原子按2:1的比例脱去生成水;
B.硝酸铵加热分解不会生成氨气;
C.氮的固定是指:游离态的氮转化为化合态;
D.加高烟囱排放废气,不能减少二氧化硫等尾气的排放.
解答 解:A.浓硫酸具有脱水性,能够使蔗糖变黑,故A错误;
B.铵盐受热分解不一定生成氨气,如:硝酸铵加热分解的化学方程式为:5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O,故B错误;
C.闪电时,氮气与氧气反应生成一氧化氮,氮元素由游离态转化物化合态,属于氮的固定,故C正确;
D.加高烟囱排放废气,不能减少二氧化硫等尾气的排放,应减少化石燃料的使用防止酸雨形成,故D错误.
故选:C.
点评 本题考查物质的性质,熟悉浓硫酸、铵盐、二氧化硫性质是解题关键,注意氮的固定的含义,题目难度不大.

练习册系列答案
相关题目
2.下列表示物质或微粒的化学用语或模型正确的是( )
| A. | N2的结构式:N-N | B. | Mg2+的结构示意图: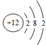 | ||
| C. | -CH3(甲基)的电子式: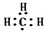 | D. | CO2分子的比例模型: |
3.下列物质,既能与盐酸反应又能与氢氧化钠溶液反应的是( )
| A. | AlCl3 | B. | Al(OH)3 | C. | KOH | D. | HCl |
7.为了探究影响化学反应速率的因素,4位同学分别设计了下列4个实验,其中结论不正确的是( )
| A. | 将大小、形状相同的镁条和铝条与相同浓度、相同温度下的盐酸反应时,两者快慢相同 | |
| B. | 盛有相同浓度双氧水的两支试管,一支加入MnO2放在冷水中,一支直接放在冷水中,前者反应快 | |
| C. | 将浓硝酸分别放在冷暗处和强光下,发现强光下的浓硝酸分解得快 | |
| D. | 升高温度,H2O2的分解速率加快,原因是反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多 |
17.下列物质:①干燥Cl2 ②NaClO ③SO2 ④活性炭 ⑤O3,能使品红褪色的是( )
| A. | ③④⑤ | B. | ②③④ | C. | ①②⑤ | D. | ①②③④⑤ |
1.如图是某有机物核磁共振氢谱图,但该物质可能是( )
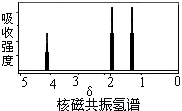

| A. | CH3COOCH2CH3 | B. | CH3CH=CHCH3 | C. | CH3CH2CH3 | D. | CH3CHOHCH3 |
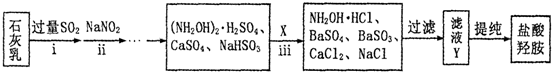
6.五氧化二钒广泛用于冶金、化工等行业,主要用于冶炼钒铁.用作合金添加剂,占五氧化二钒总消耗量的80%以上,其次是用作有机化工的催化剂.为了增加V2O5的利用率,我们从废钒催化剂(主要成分V2O5,VOSO4,K2SO4,SiO2和Fe2O3等)中回收V2O5的一种生产工艺流程示意图如下:
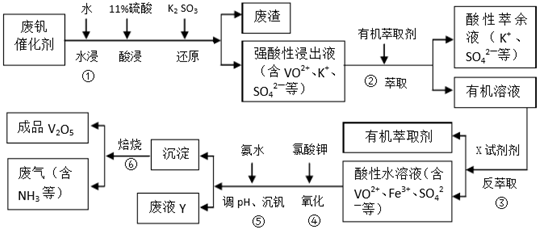
回答下列问题:
(1)①中废渣的主要成分是SiO2.
(2)②,③中的变化过程可简化为(下式中的R表示VO2+或Fe3+,HA表示有机萃取剂的主要成分):R2(SO4)n(水层)+2nHA(有基层)?2RA(有基层)+nH2SO4(水层).②中萃取时必须加入适量碱,其原因是加入碱中和硫酸使平衡正移、多次连续萃取,提高钒的萃取率;实验室进行萃取操作主要使用的玻璃仪器为分液漏斗和烧杯.
(3)完成④中反应的例子方程式:1ClO3-6VO2++6H+=6VO3+1Cl-+3H2O
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间的关系如下表:
试判断在实际生产时,⑤中加入氨水调节溶液的最佳pH为1.7;若钒沉淀率为93.1%时不产生Fe(OH)3,沉淀,则此时溶液中c(Fe3+)=2.6×10-3mol/L.(已知:25℃时k[Fe(OH)3]=2.6×10-39.)

回答下列问题:
(1)①中废渣的主要成分是SiO2.
(2)②,③中的变化过程可简化为(下式中的R表示VO2+或Fe3+,HA表示有机萃取剂的主要成分):R2(SO4)n(水层)+2nHA(有基层)?2RA(有基层)+nH2SO4(水层).②中萃取时必须加入适量碱,其原因是加入碱中和硫酸使平衡正移、多次连续萃取,提高钒的萃取率;实验室进行萃取操作主要使用的玻璃仪器为分液漏斗和烧杯.
(3)完成④中反应的例子方程式:1ClO3-6VO2++6H+=6VO3+1Cl-+3H2O
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间的关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.6 | 96.4 | 93.1 | 89.3 |
 ;
;