题目内容
10.碳元素是形成物种最多的元素之一,其中许多物质对人类来说有着极其重要的作用.(1)石墨烯是一种由碳原子构成的单层片状结构的新材料,它是世上最薄却也是最坚硬的纳米材料,同时也是世界上导电性最好的材料(结构如图1).试预测它与下列物质可能反应的是ABC.
A.氧气 B.单质氟 C.浓硝酸 D.氢氧化钠溶液
(2)①CH4(g)+H2O(g)=CO(g)+3H2(g)△H=a kJ•mol-1;
②CH3OH(g)=CO(g)+2H2(g)△H=bkJ•mol-1;
CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H=(a-b) kJ•mol-1.
(3)柠檬酸(H3Cit)是重要的三元有机酸,它的三种铵盐均易溶于水,它们可通过H3Cit与氨水反应获得,含碳各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系见图2.
①为制取NH4H2Cit,pH应控制在3.8~4.2;
②柠檬酸和一定量氨水反应所得溶液的pH约为6.7时,该反应的离子方程式为2H3Cit+5NH3•H2O=HCit2-+Cit3-+5NH4++5H2O.
(4)在25℃时,将b mol•L-1的醋酸溶液与c mol•L-1NaOH溶液等体积混合后溶液刚好呈中性,用含b、c的代数式表示CH3COOH的电离常数Ka=$\frac{10{\;}^{-7}×c}{b-c}$.

分析 (1)根据碳单质的性质结合碳单质和硅单质性质的相似性来回答;
(2)根据盖斯定律来计算化学反应的焓变,并书写热化学方程式;
(3)①根据图示信息确定制取NH4H2Cit的pH范围;
②根据图示信息知道:柠檬酸和一定量氨水反应所得溶液的pH约为6.7时,溶液中存在HCit2-、Cit3-等离子;
(4)呈中性则c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(CH3COO-)=cmol/L,CH3COOH?CH3COO-+H+电离常数Ka=$\frac{c(CH{\;}_{3}COO{\;}^{-})c(H{\;}^{+})}{c(CH{\;}_{3}COOH)}$以此计算.
解答 解:(1)根据碳单质的性质可以和氧气在点燃下反应,可以和浓硝酸加热下反应,碳单质可以和氟气之间反应,故答案为:ABC;
(2)已知:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=a kJ•mol-1;
②CH3OH(g)═CO(g)+2H2(g)△H=bkJ•mol-1;
根据盖斯定律,反应CH4(g)+H2O(g)=CH3OH(g)+H2(g),可以是①-②得到,所以该反应的△H=(a-b)kJ/mol,
故答案为:CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H=(a-b)kJ/mol;
(3)①根据图示信息知道,H2Cit-存在的pH范围大约在4左右,故答案为:3.8~4.2;
②根据图示信息知道:柠檬酸和一定量氨水反应所得溶液的pH约为6.7时,溶液中存在HCit2-、Cit3-等离子,所以反应的离子方程式为2H3Cit+5NH3•H2O=HCit2-+Cit3-+5NH4++5H2O,故答案为:2H3Cit+5NH3•H2O=HCit2-+Cit3-+5NH4++5H2O;
(4)呈中性则c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(CH3COO-)=cmol/L,所以CH3COOH?CH3COO-+H+用含b、c的代数式表示CH3COOH的电离常数Ka=$\frac{c(CH{\;}_{3}COO{\;}^{-})c(H{\;}^{+})}{c(CH{\;}_{3}COOH)}$=$\frac{10{\;}^{-7}×c}{b-c}$,
故答案为:$\frac{10{\;}^{-7}×c}{b-c}$.
点评 本题涉及碳单质的性质、电化学、热化学等方面的知识的考查,注意知识的归纳和梳理是关键,难度中等.

 阅读快车系列答案
阅读快车系列答案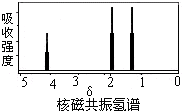
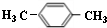
| A. | CH3COOCH2CH3 | B. | CH3CH=CHCH3 | C. | CH3CH2CH3 | D. | CH3CHOHCH3 |
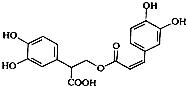
| A. | 迷迭香酸属于芳香烃 | |
| B. | 1mol迷迭香酸最多能和含6mol H2发生加成反应 | |
| C. | 迷迭香酸可以发生水解反应、消去反应和酯化反应 | |
| D. | 1mol迷迭香酸最多能和含6mol NaOH的水溶液完全反应 |
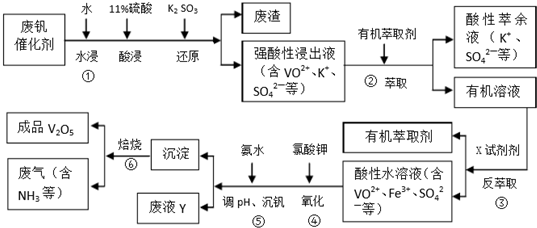
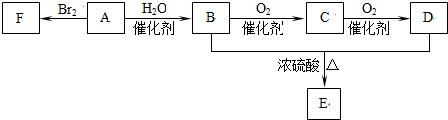
回答下列问题:
(1)①中废渣的主要成分是SiO2.
(2)②,③中的变化过程可简化为(下式中的R表示VO2+或Fe3+,HA表示有机萃取剂的主要成分):R2(SO4)n(水层)+2nHA(有基层)?2RA(有基层)+nH2SO4(水层).②中萃取时必须加入适量碱,其原因是加入碱中和硫酸使平衡正移、多次连续萃取,提高钒的萃取率;实验室进行萃取操作主要使用的玻璃仪器为分液漏斗和烧杯.
(3)完成④中反应的例子方程式:1ClO3-6VO2++6H+=6VO3+1Cl-+3H2O
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间的关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.6 | 96.4 | 93.1 | 89.3 |
 ;
;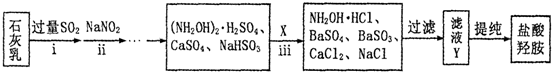
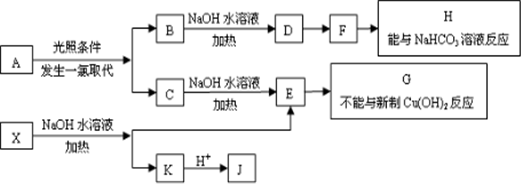
 .
.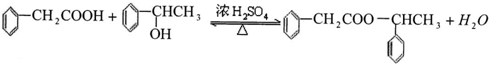 ;该反应类型是酯化反应(或取代反应).
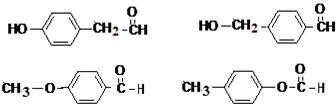
;该反应类型是酯化反应(或取代反应). .
. 任意一种.
任意一种.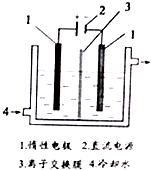 碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.请回答下列问题:
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.请回答下列问题: