题目内容
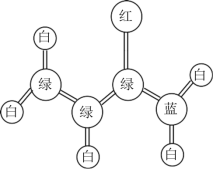
【题目】丙烯酰胺是一种重要的有机合成的中间体。它的球棍模型如图所示:(图中“棍”代表单键或双键或三键,不同颜色球表示不同原子:C、H、O、N)
(1)丙烯酰胺的分子式为___,结构简式为___。
(2)有关丙烯酰胺的说法正确的是___。
A.丙烯酰胺分子内所有原子不可能在同一平面内
B.丙烯酰胺属于烃的含氧衍生物
C.丙烯酰胺能够使酸性高锰酸钾溶液褪色
D.丙烯酰胺能够使溴的四氯化碳溶液褪色
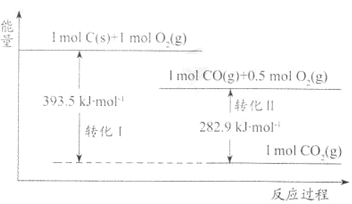
(3)工业上生产丙烯酰胺可以用下面的反应(反应均在一定条件下进行):
CH![]() CH
CH![]() CH2=CHCN
CH2=CHCN![]() 丙烯酰胺
丙烯酰胺
假设反应Ⅰ和反应Ⅱ都是原子利用率100%的反应,反应Ⅰ所需另一反应物的分子式为___,反应Ⅱ的方程式为___。
(4)聚丙烯酰胺(PAM)是一种合成有机高分子絮凝剂,写出由丙烯酰胺合成聚丙烯酰胺的化学方程式___。
【答案】C3H5ON CH2=CHCONH2 ACD HCN ![]()
 n
n
【解析】
(1)由图可知,绿球代表C、白球代表H、红球为O、蓝球为N,根据球棍模型,可得出该有机物的结构简式为![]() ,分子式为C3H5ON;
,分子式为C3H5ON;
(2)A.丙烯酰胺分子内中存在氨基,则所有原子不可能在同一平面内,A正确;
B.丙烯酰胺中含C、H、N、O四种元素,则不属于烃的含氧衍生物,B错误;
C.丙烯酰胺中含C=C,能被酸性高锰酸钾氧化,则能够使酸性高锰酸钾溶液褪色,C正确;
D.丙烯酰胺中含C=C,能与溴发生加成反应,则能够使溴的四氯化碳溶液褪色,D正确。
答案选ACD。
(3)由合成可知,Ⅰ为乙炔发生与HCN发生加成反应生成CH2=CHCN,Ⅱ为—CN与水的加成反应,该反应为![]() ;
;
(4)由丙烯酰胺合成聚丙烯酰胺,发生加聚反应,该反应为 。
。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】某实验小组设计用50mL1.0 mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图装置中进行中和反应。在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
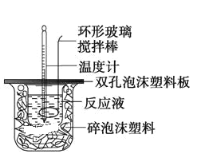
(1)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和。试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热___(填“偏大”“偏小”或“不变”)。
(2)该实验小组做了三次实验,每次取溶液各50 mL,并记录如下原始数据。
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)/℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
1 | 24.8 | 25.2 | 25.0 | 31.6 | 6.6 |
2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
3 | 25.2 | 25.0 | 25.1 | 31.9 | 6.8 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容c=4.18×10-3 kJ/(g·℃),混合后溶液质量为m,反应放出的热量Q=cm△t,则该反应生成水的物质的量为____,中和热为ΔH=____。
(3)若用等浓度的盐酸与NH3·H2O溶液反应,则测得的中和热会___(填“偏大”“偏小”或“不变”),其原因是____。
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热____(填“偏大”“偏小”或“不变”)。
【题目】某实验小组设计实验,利用酸性KMnO4溶液与H2C2O4溶液反应,测定溶液紫色消失所需时间的方法,研究浓度对反应速率的影响。供选择的实验药品有:0.01mol·L-1酸性KMnO4溶液、0.1mol·L-1酸性KMnO4溶液、0.1mol·L-1H2C2O4溶液、0.2mol·L-1H2C2O4溶液。
(1)H2C2O4溶液与酸性KMnO4溶液反应的离子方程式为_______________。
(2)请完成以下实验设计表。
实验 | 酸性KMnO4溶液 | H2C2O4溶液 | 褪色时间/s | ||
c/(mol·L-1) | V/mL | c/(mol·L-1) | V/mL | ||
甲 | 0.01 | 4 | 0.1 | 2 | t1 |
乙 | a | 4 | b | 2 | t2 |
①表中a=________、b=________;
②甲组实验KMnO4的平均反应速率是:____________(用含t1的式子表示)。
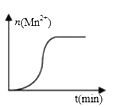
(3)测得某次实验(恒温)时,溶液中Mn2+物质的量与时间关系如图。请解释n(Mn2+)在反应起始时变化不大、一段时间后快速增大的原因:___________________。