题目内容
【题目】微生物燃料电池在净化废水(含有Cr2O![]() 离子)的同时能获得能源或得到有价值的化学产品,图为其工作原理。下列说法正确的是( )
离子)的同时能获得能源或得到有价值的化学产品,图为其工作原理。下列说法正确的是( )
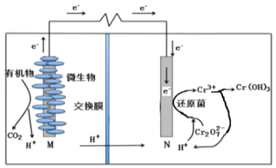
A.M为电源负极,有机物被还原
B.电池工作时,N极附近溶液pH减小
C.处理1molCr2O![]() 时有14molH+从交换膜左侧向右侧迁移
时有14molH+从交换膜左侧向右侧迁移
D.Cr2O![]() 离子浓度较大时,可能会造成还原菌失活
离子浓度较大时,可能会造成还原菌失活
【答案】D
【解析】
原电池装置图中H+向右移动,则N电极为正极,发生得到电子的还原反应,Cr2O72-得电子生成Cr3+,电极反应式为Cr2O72-+6e-+14H+=2Cr3++7H2O,M极失电子发生氧化反应,有机物被氧化生成CO2,为原电池的负极,以此解答该题。
A.根据分析,M为电源负极,有机物被氧化,A选项错误;
B.根据图示,正极反应为Cr2O72-+6e-+14H+=2Cr3++7H2O,消耗氢离子,N极附近溶液pH增大,B选项错误;
C.Cr元素由+6价变为+3价,处理1mol![]() 时转移6mol电子,所以至少有6molH+从交换膜左侧移向右侧,C选项错误;
时转移6mol电子,所以至少有6molH+从交换膜左侧移向右侧,C选项错误;
D.Cr2O72-具有强氧化性,能使蛋白质变性,浓度较大时,可能会造成还原菌失活,D选项正确;
答案选D。

 名校课堂系列答案
名校课堂系列答案【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 室温下,向苯酚钠溶液中通足量CO2,溶液变浑浊 | 碳酸的酸性比苯酚的强 |
B | 加热乙醇与浓硫酸的混合溶液,将产生的气体通入少量酸性KMnO4溶液,溶液紫红色褪去 | 有乙烯生成 |
C | 向5 mL 0.1 mol·L1 KI溶液中加入1 mL 0.1 mol·L1 FeCl3溶液,充分反应后,萃取分液,向水层中滴加KSCN溶液,溶液呈血红色 | I-与Fe3+的反应有一定限度 |
D | 向NaHCO3溶液中滴加紫色石蕊试液,溶液变蓝 | Kw<Ka1(H2CO3)×Ka2(H2CO3) |
A.AB.BC.CD.D