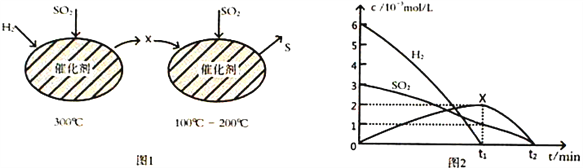
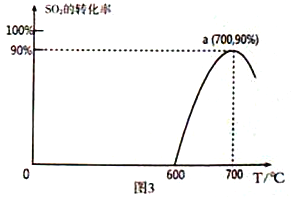
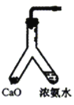
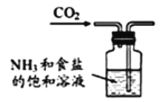
题目内容
【题目】钾玻璃中含有18.4%的K2O,11.0%的CaO,70.6%的SiO2。
(1)计算三种氧化物的物质的量之比_________。
(2)若需制造5.1 t 钾玻璃,需用碳酸钾、石灰石、石英各_________吨?
(3)生产过程中释放出_________吨温室气体二氧化碳?
【答案】1∶1∶6 1.38 t、1.00 t、3.6 t 0.88 t
【解析】
(1)利用质量分数确定这三种氧化物的物质的量之比;
(2)根据CaCO3~CaO,K2O~K2CO3,计算原料的物质的量之比,再根据需制造5.10t钾玻璃求解;
(3)根据方程式计算。
(1)n(K2O)∶n(CaO)∶n(SiO2)=![]() ∶
∶![]() ∶
∶![]() ≈1∶1∶6,故答案为:1∶1∶6;
≈1∶1∶6,故答案为:1∶1∶6;
(2)化学式为K2O·CaO·6SiO2,其摩尔质量M=510 g·mol-1,钾玻璃物质的量n=![]() =104mol
=104mol
由原子守恒计算可知:
m(K2CO3)=n(K2CO3)×138 g·mol-1=104mol×138 g·mol-1=1.38 t,
m(CaCO3)=n(CaCO3)×100 g·mol-1=104mol×100 g·mol-1=1.00 t,
m(SiO2)=n(SiO2)×360 g·mol-1=104mol×360 g·mol-1=3.6 t,故答案为:1.38 t、1.00 t、3.6 t;
(3)在玻璃熔炉中发生反应:
CaCO3+SiO2![]() CaSiO3+CO2↑,K2CO3+SiO2
CaSiO3+CO2↑,K2CO3+SiO2![]() K2SiO3+CO2↑,
K2SiO3+CO2↑,
生成二氧化碳的物质的量与参加反应二氧化硅的物质的量相等,m(CO2)=n(CO2)×44 g·mol-1=2×104mol×44 g·mol-1=0.88t,故答案为:0.88 t。

练习册系列答案
相关题目