题目内容
11.已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同电子层结构,关于A、B、C、D四种元素的叙述正确的是( )| A. | 气态氢化物的稳定性:D>C | |
| B. | 原子序数:b>a>c>d | |
| C. | 最高价氧化物对应水化物的碱性:B>A | |
| D. | 原子半径:B>A>D>C |
分析 已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,则有:a-n=b-(n+1)=c+n=d+(n+1),则有A、B在周期表中C、D的下一周期,并且原子序数:b>a>c>d,由离子所带电荷,可知A、B属于金属元素,C、D属于非金属性元素,结合元素周期律递变规律解答该题.
解答 解:已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,则有:a-n=b-(n+1)=c+n=d+(n+1),则有A、B在周期表中C、D的下一周期,并且原子序数:b>a>c>d,由离子所带电荷,可知A、B属于金属元素,C、D属于非金属性元素,则:
A.C、D在同一周期,且原子序数C>D,非金属性:C>D,则气态氢化物的稳定性:C>D,故A错误;
B.已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,则有:a-n=b-(n+1)=c+n=d+(n+1),则有原子序数:b>a>c>d,故B正确;
C.A、B在周期表中同周期,原子序数:b>a,金属性:A>B,最高价氧化物对应水化物的碱性:A>B,故C错误;
D.A、B在周期表中C、D的下一周期,并且原子序数:b>a>c>d,原子核外电子层数越多,原子半径越大,同周期元素原子序数越大,原子半径越小,则有原子半径:A>B>D>C,故D错误.
故选B.
点评 本题考查位置结构性质关系及应用,关键是根据核外电子排布确定元素所在周期表中的相对位置,注意对元素周期律的理解掌握,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.下列说法正确的是( )
| A. | 水的离子积常数KW随着温度的升高而增大,说明水的电离过程是吸热的 | |
| B. | 弱电解质溶液稀释后,溶液中各种离子浓度一定都减小 | |
| C. | 某盐的水溶液呈酸性,该盐一定是强酸弱碱盐 | |
| D. | 中和相同体积相同pH的盐酸和醋酸溶液所需NaOH的物质的量相同 |
2.下列微粒中,对水的电离平衡不产生影响的是( )
| A. | 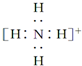 | B. |  | C. | 26R3+ | D. | 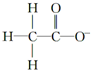 |
19.硼酸(H3BO3)分子的中心原子B最外层电子并未达到饱和,它在水中结合水分子电离出来的OH-使B原子最外层电子达到饱和,电离过程如图所示.下列表述正确的是( )
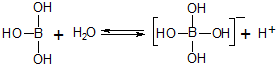
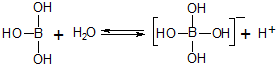
| A. | 硼酸加入水中抑制水的电离 | |
| B. | 硼酸是三元酸 | |
| C. | 硼酸与强碱在溶液中反应:H3BO3+OH-═[B(OH)4]- | |
| D. | 硼酸是两性化合物 |
6.下列说法正确的是( )
| A. | ${\;}_{53}^{131}$I与${\;}_{53}^{125}$I 互为同位素 | |
| B. | ${\;}_{53}^{131}$I与${\;}_{53}^{125}$I性质完全相同 | |
| C. | ${\;}_{94}^{224}$Pu位于周期表中第六周期 | |
| D. | ${\;}_{53}^{131}$I的质子数为78 |
16.J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表所示.已知J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素.下列说法错误的是( )
| J | ||
| R |
| A. | M和T组成的化合物是共价化合物 | |
| B. | M单质能与氢氧化钠溶液反应,产生一种可燃性气体 | |
| C. | R、T两元素的气态氢化物中,R的气态氢化物更稳定 | |
| D. | J、M、R、T元素最高价氧化物对应的水化物中酸性最强的是HTO4 |
3.如图是氢氧燃料电池构造示意图.关于该电池的说法不正确的是( )


| A. | a极是正极 | B. | 电池总反应式为:2H2+O2=2H2O | ||
| C. | 电子由b通过灯泡流向a | D. | 氢氧燃料电池是环保电池 |
1.某同学组装了如图所示的电化学装置,则下列说法正确的是( )
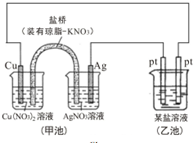

| A. | 实验过程中,甲池左侧烧杯中NO3-的浓度增大 | |
| B. | 图中甲池中的盐桥可以是装琼脂的饱和KCl溶液 | |
| C. | 若乙池为Na2SO4溶液,一段时间后,右边Pt极上产生了0.672L气体(标准状况),则甲池中Ag电极质量增加12.96g | |
| D. | Cu电极发生还原反应 |
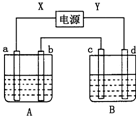 如图所示装置,X、Y为电源的两极,a、b均为石墨电极,c为铜电极,d为铁电极,A槽中盛装饱和食盐水,B槽中盛装CuCl2溶液.通电一段时间后,发现d电极上覆盖一层红色物质.
如图所示装置,X、Y为电源的两极,a、b均为石墨电极,c为铜电极,d为铁电极,A槽中盛装饱和食盐水,B槽中盛装CuCl2溶液.通电一段时间后,发现d电极上覆盖一层红色物质.