题目内容
16.J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表所示.已知J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素.下列说法错误的是( )| J | ||
| R |
| A. | M和T组成的化合物是共价化合物 | |
| B. | M单质能与氢氧化钠溶液反应,产生一种可燃性气体 | |
| C. | R、T两元素的气态氢化物中,R的气态氢化物更稳定 | |
| D. | J、M、R、T元素最高价氧化物对应的水化物中酸性最强的是HTO4 |
分析 J、M、R、T是原子序数依次增大的短周期主族元素,由元素在周期表中的位置可知,J处于第二周期,R处于第三周期,J元素最低负化合价的绝对值与其原子最外层电子数相等,故J原子最外层电子数为4,故J为碳元素,R为硫元素,T的原子序数最大,故T为Cl元素,M是地壳中含量最多的金属元素,则M为Al元素,据此解答.
解答 解:J、M、R、T是原子序数依次增大的短周期主族元素,由元素在周期表中的位置可知,J处于第二周期,R处于第三周期,J元素最低负化合价的绝对值与其原子最外层电子数相等,故J原子最外层电子数为4,故J为碳元素,R为硫元素,T的原子序数最大,故T为Cl元素,M是地壳中含量最多的金属元素,则M为Al元素.
A.M和T组成的化合物是AlCl3,属于共价化合物,故A正确;
B.Al单质能与氢氧化钠溶液反应生成偏铝酸钠与氢气,氢气是一种可燃性气体,故B正确;
C.R、T两元素的气态氢化物为H2S、HCl,Cl元素的非金属性比硫的强,故T的气态氢化物HCl更稳定,故C错误;
D.C、Al、S、Cl元素中Cl元素非金属性最强,故最高价氧化物对应的水化物中酸性最强的是HClO4,故D正确,
故选:C.
点评 本题考查位置结构性质关系应用,推断元素是解题关键,侧重于元素周期表和周期律的应用的考查,题目难度不大.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
6.常温下,下列有关叙述正确的是( )
| A. | 水的离子积KW只与温度有关,但水的电离程度一定会受外加酸、碱、盐的影响 | |
| B. | 若HA的Ka=1.7×10-5,BOH的Kb=1.7×10-5,则HA溶液中的c(H+)与BOH中的c(OH-)相等 | |
| C. | 将0.2mol/L HA溶液和0.1mol/L NaOH溶液等体积混合,则反应后的混合液中:c(OH-)+c(A-)=c(H+)+c(HA) | |
| D. | Mg(OH)2能溶于NH4Cl浓溶液的主要原因是NH4+结合OH-使沉淀溶解平衡发生正向移动 |
7.下列实验操作中正确的是( )
| A. | 用湿润的pH试纸测定某稀醋酸溶液的pH | |
| B. | 做完银镜反应的试管可以用氨水来洗涤 | |
| C. | 如果苯酚浓溶液沾到皮肤上,应立即用酒精擦洗 | |
| D. | 为了除去苯中混有的少量苯酚,加入足量浓溴水,充分搅拌后过滤分离 |
11.已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同电子层结构,关于A、B、C、D四种元素的叙述正确的是( )
| A. | 气态氢化物的稳定性:D>C | |
| B. | 原子序数:b>a>c>d | |
| C. | 最高价氧化物对应水化物的碱性:B>A | |
| D. | 原子半径:B>A>D>C |
1.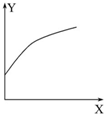 在密闭的容积可变的容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,改变一个条件,下列量(Y)的变化不符合图中曲线的是( )
在密闭的容积可变的容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,改变一个条件,下列量(Y)的变化不符合图中曲线的是( )
 在密闭的容积可变的容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,改变一个条件,下列量(Y)的变化不符合图中曲线的是( )
在密闭的容积可变的容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,改变一个条件,下列量(Y)的变化不符合图中曲线的是( )| X | Y | |
| A | 再加入A | B的转化率 |
| B | 降低温度 | 混合气体的密度 |
| C | 增大压强 | A的转化率 |
| D | 升高温度 | 混合气体的平均摩尔质量 |
| A. | A | B. | B | C. | C | D. | D |
8.下列关于催化剂的说法,正确的是( )
| A. | 催化剂能使不起反应的物质发生反应 | |
| B. | 在化学反应前后催化剂性质和质量都不改变 | |
| C. | 催化剂能改变化学反应速率 | |
| D. | 在化学反应过程中,催化剂能提高转化率 |
6.取两份质量相等的有机物M,一份与足量的钠反应放出气体V1升,另一份与足量NaHCO3溶液反应放出气体V2升;若同温同压下V1=V2,则M是( )
| A. | HCOOH | B. | HOOC-COOH | C. | HOCH2CH2COOH | D. | HOC6H4OOCH |
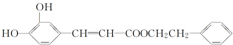 )是一种天然抗癌药物.在一定条件下能发生如下转化.
)是一种天然抗癌药物.在一定条件下能发生如下转化.
 .
. .
.