题目内容
1.下列说法正确的是( )| A. | 水的离子积常数KW随着温度的升高而增大,说明水的电离过程是吸热的 | |
| B. | 弱电解质溶液稀释后,溶液中各种离子浓度一定都减小 | |
| C. | 某盐的水溶液呈酸性,该盐一定是强酸弱碱盐 | |
| D. | 中和相同体积相同pH的盐酸和醋酸溶液所需NaOH的物质的量相同 |
分析 A.水的离子积常数KW随着温度的升高而增大,说明升高温度后水的电离向着正向移动;
B.稀释过程中,水的离子积不变,若氢离子浓度减小,则氢氧根离子浓度增大;
C.该盐可能为强酸的酸式盐或弱酸酸式盐,如硫酸氢钠溶液、亚硫酸氢钠;
D.醋酸为弱酸,pH相同时醋酸的浓度大于盐酸.
解答 解:A.水的离子积常数KW随着温度的升高而增大,说明升高温度平衡向着正向移动,则正向为吸热反应,即水的电离过程是吸热的,故A正确;
B.由于水的离子积不变,所以稀释过程中氢离子和氢氧根离子的浓度变化不会一致,若氢离子浓度增大,则氢氧根离子浓度减小,所以稀释过程中不可能各种离子浓度都减小,故B错误;
C.某盐的水溶液呈酸性,该盐可能为强酸的酸式盐,如硫酸氢钠,也可能为弱酸的酸式盐,如亚硫酸氢钠,不一定为强酸弱碱盐,故C错误;
D.醋酸为弱电解质,pH相同时醋酸的浓度大于盐酸,则等体积时醋酸的物质的量大于氯化氢,用氢氧化钠中和时醋酸消耗的氢氧化钠的物质的量大,故D错误;
故选A.
点评 本题考查了弱电解质的电离、盐的水解原理、水的电离及其影响等知识,题目难度中等,明确弱电解质的电离平均及其影响因素为解答关键,注意掌握盐的水解原理及其应用方法.

练习册系列答案
相关题目
1.分析下表中有机物的排列规律,可写出空格上物质的分子式,则横线上能与金属钠反应放出氢气的有机物有(不含立体异构)( )
| 1 | 2 | 3 | 4 | 5 | 6 | … |
| CH4O | C2H6O | C3H8O | C5H12O | C6H14O | … |
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
12.下列说法中正确的是( )
| A. | 近期媒体报道的某白酒中添加的塑化剂是对人体健康无害的物质 | |
| B. | 尽量使用含12C的产品,减少使用含13C或14C的产品符合“低碳经济”宗旨 | |
| C. | 大量二氧化碳气体的排放是形成酸雨的主要原因 | |
| D. | 使用太阳能、风能、潮汐能等能源能减少PM2.5的污染 |
6.常温下,下列有关叙述正确的是( )
| A. | 水的离子积KW只与温度有关,但水的电离程度一定会受外加酸、碱、盐的影响 | |
| B. | 若HA的Ka=1.7×10-5,BOH的Kb=1.7×10-5,则HA溶液中的c(H+)与BOH中的c(OH-)相等 | |
| C. | 将0.2mol/L HA溶液和0.1mol/L NaOH溶液等体积混合,则反应后的混合液中:c(OH-)+c(A-)=c(H+)+c(HA) | |
| D. | Mg(OH)2能溶于NH4Cl浓溶液的主要原因是NH4+结合OH-使沉淀溶解平衡发生正向移动 |
13.下列说法错误的是( )
| A. | 反应产物的总焓与反应物的总焓之差,称为反应焓变 | |
| B. | 反应产物的总焓小于反应物的总焓,该反应为吸热反应 | |
| C. | 同一反应在不同温度下进行,其焓变是不同的 | |
| D. | 已知2NO2(g)═N2O4(g)△H1,N2O4(g)═2NO2(g)△H2,则△H1=-△H2 |
10.某同学做完铜、锌、稀硫酸原电池的实验后得出了下列结论,你认为正确的是( )
| A. | 构成原电池正极和负极的材料必须是两种金属 | |
| B. | 当由铜、锌电极与硫酸铜溶液组成原电池时,铜是负极 | |
| C. | 负极反应为:2H++2e-═H2↑ | |
| D. | 该装置能将化学能转化为电能 |
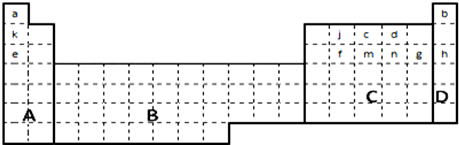
11.已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同电子层结构,关于A、B、C、D四种元素的叙述正确的是( )
| A. | 气态氢化物的稳定性:D>C | |
| B. | 原子序数:b>a>c>d | |
| C. | 最高价氧化物对应水化物的碱性:B>A | |
| D. | 原子半径:B>A>D>C |
 .
. CH3COOC2H5+H2O,该反应类型是酯化(取代)反应.
CH3COOC2H5+H2O,该反应类型是酯化(取代)反应. 2CH3CHO+2H2O.
2CH3CHO+2H2O.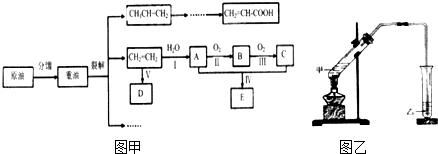
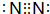 .
.