题目内容
2.下列微粒中,对水的电离平衡不产生影响的是( )| A. | 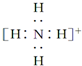 | B. | 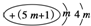 | C. | 26R3+ | D. | 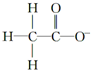 |
分析 水的电离H20?H++OH-是一电离平衡,根据影响因素来进行判断,影响因素有温度、酸、碱、盐等,加热促进电离;加酸、加碱抑制水的电离;能水解的盐促进水的电离;据此即可解答.
解答 解:A、铵根离子能和氢氧根离子反应生成弱电解质一水合氨,所以能促进水电离,故A不选;
B、原子结构示意图可知m=2,核电核数为11,为钠离子,对水的电离无影响,故B选;
C、分析可知为Fe3+,溶液中水解促进水的电离,故C不选;
D、结构式表示的是乙酸根离子,是弱酸的阴离子,水溶液中能水解,促进水的电离,故D不选;
故选B.
点评 本题考查了对水电离的影响因素,解答的关键是抓住酸或碱抑制水的电离,加入能水解的盐促进水电离.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列说法中正确的是( )
| A. | 近期媒体报道的某白酒中添加的塑化剂是对人体健康无害的物质 | |
| B. | 尽量使用含12C的产品,减少使用含13C或14C的产品符合“低碳经济”宗旨 | |
| C. | 大量二氧化碳气体的排放是形成酸雨的主要原因 | |
| D. | 使用太阳能、风能、潮汐能等能源能减少PM2.5的污染 |
13.下列说法错误的是( )
| A. | 反应产物的总焓与反应物的总焓之差,称为反应焓变 | |
| B. | 反应产物的总焓小于反应物的总焓,该反应为吸热反应 | |
| C. | 同一反应在不同温度下进行,其焓变是不同的 | |
| D. | 已知2NO2(g)═N2O4(g)△H1,N2O4(g)═2NO2(g)△H2,则△H1=-△H2 |
10.某同学做完铜、锌、稀硫酸原电池的实验后得出了下列结论,你认为正确的是( )
| A. | 构成原电池正极和负极的材料必须是两种金属 | |
| B. | 当由铜、锌电极与硫酸铜溶液组成原电池时,铜是负极 | |
| C. | 负极反应为:2H++2e-═H2↑ | |
| D. | 该装置能将化学能转化为电能 |
17.下列说法不正确的是( )
| A. | 晶体硅是将太阳能转化为电能的常用材料 | |
| B. | 用加热的方法杀死H7N9禽流感病毒是采用了蛋白质变性原理 | |
| C. | “克隆羊”的关键技术之一是找到一些激活普通细胞的酶,并将它浸泡在酒精中保存 | |
| D. | 钠钾合金在常温下呈液态,可用于快中子反应堆作热交换剂 |
7.下列实验操作中正确的是( )
| A. | 用湿润的pH试纸测定某稀醋酸溶液的pH | |
| B. | 做完银镜反应的试管可以用氨水来洗涤 | |
| C. | 如果苯酚浓溶液沾到皮肤上,应立即用酒精擦洗 | |
| D. | 为了除去苯中混有的少量苯酚,加入足量浓溴水,充分搅拌后过滤分离 |
14.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 常温常压下,20 g D2O和足量的金属钠反应产生气体的分子数为0.5NA | |
| B. | 1 mol Na2O2与足量的水反应,转移的电子数为2NA | |
| C. | NA 个SO3分子在标准状况下的体积为22.4 L | |
| D. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA |
11.已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同电子层结构,关于A、B、C、D四种元素的叙述正确的是( )
| A. | 气态氢化物的稳定性:D>C | |
| B. | 原子序数:b>a>c>d | |
| C. | 最高价氧化物对应水化物的碱性:B>A | |
| D. | 原子半径:B>A>D>C |
12.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 新制的氯水中:Ba2+、Fe2+、CO32- | |
| B. | 0.1 mol•L-1HNO3溶液中:Mg2+、SO42-、Cl- | |
| C. | 0.1 mol•L-1NH4Cl溶液中:K+、OH-、SO42- | |
| D. | 使石蕊变红色的溶液中:Na+、Cu2+、HCO3- |