题目内容
19.硼酸(H3BO3)分子的中心原子B最外层电子并未达到饱和,它在水中结合水分子电离出来的OH-使B原子最外层电子达到饱和,电离过程如图所示.下列表述正确的是( )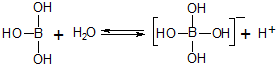
| A. | 硼酸加入水中抑制水的电离 | |
| B. | 硼酸是三元酸 | |
| C. | 硼酸与强碱在溶液中反应:H3BO3+OH-═[B(OH)4]- | |
| D. | 硼酸是两性化合物 |
分析 A.硼酸的电离结合了水溶液中的氢氧根离子;
B.根据硼酸电离出的氢离子的数目可以看出是几元酸;
C.硼酸能和OH-发生化合反应,而使中心原子最外层电子达到饱和结构;
D.硼酸是酸,电离出的阳离子全部是氢离子.
解答 解:A.硼酸在水中的电离过程为: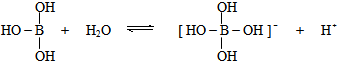 ,可以看出硼酸的电离结合了水溶液中的氢氧根离子,对水的电离起促进作用,故A错误;
,可以看出硼酸的电离结合了水溶液中的氢氧根离子,对水的电离起促进作用,故A错误;
B.硼酸电离出的氢离子的数目是1,可以,得出硼酸是一元酸,故B错误;
C.硼酸能和强碱溶液中的OH-发生化合反应,而使中心原子最外层电子达到饱和结构,即:H3BO3+OH-=[B(OH)4]-,故C正确;
D.硼酸电离出的阳离子全部是氢离子,属于酸,故D错误;
故选C.
点评 本题考查弱电解质在水溶液中的电离,为高频考点,题目难度中等,正确获取信息并利用信息解答问题是解本题关键,侧重考查学生自学及知识迁移能力.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
10.某同学做完铜、锌、稀硫酸原电池的实验后得出了下列结论,你认为正确的是( )
| A. | 构成原电池正极和负极的材料必须是两种金属 | |
| B. | 当由铜、锌电极与硫酸铜溶液组成原电池时,铜是负极 | |
| C. | 负极反应为:2H++2e-═H2↑ | |
| D. | 该装置能将化学能转化为电能 |
7.下列实验操作中正确的是( )
| A. | 用湿润的pH试纸测定某稀醋酸溶液的pH | |
| B. | 做完银镜反应的试管可以用氨水来洗涤 | |
| C. | 如果苯酚浓溶液沾到皮肤上,应立即用酒精擦洗 | |
| D. | 为了除去苯中混有的少量苯酚,加入足量浓溴水,充分搅拌后过滤分离 |
14.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 常温常压下,20 g D2O和足量的金属钠反应产生气体的分子数为0.5NA | |
| B. | 1 mol Na2O2与足量的水反应,转移的电子数为2NA | |
| C. | NA 个SO3分子在标准状况下的体积为22.4 L | |
| D. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA |
11.已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同电子层结构,关于A、B、C、D四种元素的叙述正确的是( )
| A. | 气态氢化物的稳定性:D>C | |
| B. | 原子序数:b>a>c>d | |
| C. | 最高价氧化物对应水化物的碱性:B>A | |
| D. | 原子半径:B>A>D>C |
8.下列关于催化剂的说法,正确的是( )
| A. | 催化剂能使不起反应的物质发生反应 | |
| B. | 在化学反应前后催化剂性质和质量都不改变 | |
| C. | 催化剂能改变化学反应速率 | |
| D. | 在化学反应过程中,催化剂能提高转化率 |
9.有机物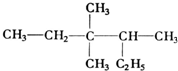 的正确命名为( )
的正确命名为( )
 的正确命名为( )
的正确命名为( )| A. | 2-乙基-3,3-二甲基-4-乙基戊烷 | B. | 3,3,4-三甲基已烷 | ||
| C. | 3,3-二甲基-4-乙基戊烷 | D. | 2,3,3-三甲基已烷 |
 .
. CH3COOC2H5+H2O,该反应类型是酯化(取代)反应.
CH3COOC2H5+H2O,该反应类型是酯化(取代)反应. 2CH3CHO+2H2O.
2CH3CHO+2H2O.
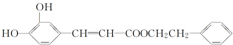 )是一种天然抗癌药物.在一定条件下能发生如下转化.
)是一种天然抗癌药物.在一定条件下能发生如下转化.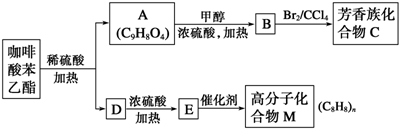
 .
. .
.