题目内容
3.如图是氢氧燃料电池构造示意图.关于该电池的说法不正确的是( )
| A. | a极是正极 | B. | 电池总反应式为:2H2+O2=2H2O | ||
| C. | 电子由b通过灯泡流向a | D. | 氢氧燃料电池是环保电池 |
分析 氢氧燃料电池中,通入氢气的一极为电源的负极,发生氧化反应,电极反应式为H2-2e-=2H+,通入氧气的一极为原电池的正极,电极反应式为O2+4H++4e-=2H2O,原电池工作时,电子由负极经外电路流向正极,以此解答该题.
解答 解:A.氢氧燃料电池中,H2在负极a上被氧化,故A错误;
B.通入氧气的一极为原电池的正极,由于电解质溶液为酸性,正极的电极反应是O2+4H++4e-=2H2O,负极反应为H2-2e-=2H+,则总方程式为2H2+O2=2H2O,故B正确;
C.原电池工作时,电子由负极经外电路流向正极,即由a通过灯泡流向b,故C错误;
D.氢氧燃料电池的总反应为:2H2+O2=2H2O,属于环保电池,故D正确.
故选AC.
点评 本题考查原电池的工作原理,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意把握电极方程式的书写,特别是电解质溶液的酸碱性.

练习册系列答案
相关题目
13.下列说法错误的是( )
| A. | 反应产物的总焓与反应物的总焓之差,称为反应焓变 | |
| B. | 反应产物的总焓小于反应物的总焓,该反应为吸热反应 | |
| C. | 同一反应在不同温度下进行,其焓变是不同的 | |
| D. | 已知2NO2(g)═N2O4(g)△H1,N2O4(g)═2NO2(g)△H2,则△H1=-△H2 |
14.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 常温常压下,20 g D2O和足量的金属钠反应产生气体的分子数为0.5NA | |
| B. | 1 mol Na2O2与足量的水反应,转移的电子数为2NA | |
| C. | NA 个SO3分子在标准状况下的体积为22.4 L | |
| D. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA |
11.已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同电子层结构,关于A、B、C、D四种元素的叙述正确的是( )
| A. | 气态氢化物的稳定性:D>C | |
| B. | 原子序数:b>a>c>d | |
| C. | 最高价氧化物对应水化物的碱性:B>A | |
| D. | 原子半径:B>A>D>C |
18.已知:H2(g)+F2(g)═2HF(g)△H=-546.6kJ•mol-1,下列说法中不正确的是( )
| A. | 44.8 L氟化氢气体分解成22.4 L的氢气和22.4 L的氟气吸收546.6 kJ热量 | |
| B. | 1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量大于546.6 kJ | |
| C. | 相同条件下,1 mol氢气与1 mol氟气的能量总和高于2 mol氟化氢气体的能量 | |
| D. | 2 mol H-F键的键能比1 mol H-H键和1 mol F-F 键的键能之和大546.6 kJ |
8.下列关于催化剂的说法,正确的是( )
| A. | 催化剂能使不起反应的物质发生反应 | |
| B. | 在化学反应前后催化剂性质和质量都不改变 | |
| C. | 催化剂能改变化学反应速率 | |
| D. | 在化学反应过程中,催化剂能提高转化率 |
15.室温下,下列叙述正确的是( )
| A. | 向10ml 0.1mol•L-1NH4HSO4溶液中滴加10ml 0.1mol•L-1NaOH溶液:2c(SO42-)═c(NH4+)+c(NH3•H2O) | |
| B. | 等体积等浓度NaHCO3溶液和Na2CO3溶液混合:$\frac{C(HC{O}_{3}^{-})}{C({H}_{2}C{O}_{3})}$<$\frac{C(C{O}_{3}^{2-})}{C(HC{O}_{3}^{-})}$ | |
| C. | 物质的量浓度均为0.1mol•L-1Na2S溶液、NaHS溶液等体积混合所得溶液中:2c(OH--)-2c(H+)═3 c(H2S)+c(HS--)-c(S2--) | |
| D. | 将足量的AgCl分别放入:①5 ml水 ②10 ml 0.2mol•L-1MgCl2溶液③20ml0.3mol•L-1盐酸中溶解至饱和,c(Ag+):①>②>③ |
12.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 新制的氯水中:Ba2+、Fe2+、CO32- | |
| B. | 0.1 mol•L-1HNO3溶液中:Mg2+、SO42-、Cl- | |
| C. | 0.1 mol•L-1NH4Cl溶液中:K+、OH-、SO42- | |
| D. | 使石蕊变红色的溶液中:Na+、Cu2+、HCO3- |
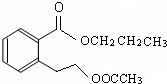 或
或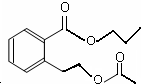 .
.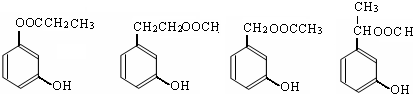 (任意两个).
(任意两个).