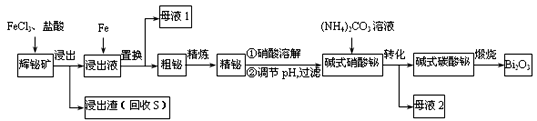
题目内容
【题目】工业上,煤的气化和液化是高效、清洁、综合利用煤炭的重要途径。
(1)一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应:C(s)+2H2O(g)![]() CO2(g)+2H2(g) ΔH1>0,相关数据如下表:
CO2(g)+2H2(g) ΔH1>0,相关数据如下表:
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | |
C(s) | H2O(g) | H2(g) | |||
甲 | 2 | T1 | 3 | 4 | 3.2 |
乙 | 1 | T2 | 1.5 | 2 | 1.2 |
①T1___T2(填“>、<或=”)。
②T1时达到平衡后再加入1molH2O(g),达到新平衡后H2(g)的物质的量分数___(填“增大”“不变”或“减小”);T2时,若起始时乙容器中加入1.5molC(s)、1.2molH2O(g)、0.5molCO2(g)、1.4molH2(g),此时v正___v逆(填“>、<或=”)。
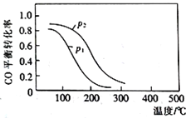
(2)煤液化时发生反应:CO(g)+2H2(g)![]() CH3OH(g)ΔH2,在10L恒容密闭容器中按物质的量之比1:2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时,n(H2)随时间的变化如下表所示:
CH3OH(g)ΔH2,在10L恒容密闭容器中按物质的量之比1:2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时,n(H2)随时间的变化如下表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①ΔH2___0(填“>、<或=”)。
②下列说法正确的是___(填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强P1<P2
③0-3min内用CH3OH表示的反应速率v(CH3OH)=___mol/(L·min)(结果保留两位有效数值)。
④200℃时,该反应的平衡常数K=___。向上述200℃达到平衡的恒容密闭容器中再加入2molCO、2molH2、2molCH3OH,保持温度不变,则化学平衡___(填“正向”、“逆向”或“不”)移动。
【答案】> 减小 > < cd 0.067 6.25 正向
【解析】
(1)①甲、乙中水蒸气浓度相等,只有温度不同,该反应的正反应是吸热反应,升高温度平衡正向移动,则生成的氢气越多,甲中氢气物质的量大于乙中2倍,说明甲的温度高;
②T1时达到平衡后再加入1molH2O(g),容器的体积不变,等效于加压过程,平衡逆向移动;T2时,利用三段式可求出该反应的平衡常数;利用浓度商Qc与平衡常数K的大小关系,判定平衡移动方向,得出v正与v逆的关系;
(2)①随温度的升高CO转化率降低,说明平衡向着逆反应方向进行,逆反应为吸热反应;
②根据外界条件对平衡移动的影响规律、外界条件对平衡常数的影响规律、平衡状态的判定标准进行综合分析;
③结合图表信息,根据![]() 进行计算;
进行计算;
④200℃时,利用三段式可求出该反应的平衡常数;根据浓度熵Qc与平衡常数K的大小关系,判定平衡移动方向。
(1)①甲、乙中水蒸气浓度相等,只有温度不同,该反应的正反应是吸热反应,升高温度平衡正向移动,则生成的氢气越多,甲中氢气物质的量大于乙中2倍,说明甲的温度高,则T1>T2;
②T1时达到平衡后再加入1molH2O(g),平衡正向移动,但与原平衡相比,相当于增加压强,平衡向气体体积减小方向移动,即逆向移动,所以达到新平衡后H2(g)的物质的量分数减小;
T2时,利用三等式可求出该反应的平衡常数,有
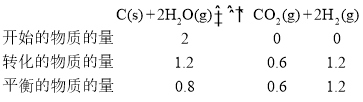
化学平衡常数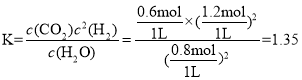 ;若起始时乙容器中加入1.5molC(s)、1.2molH2O(g)、0.5molCO2(g)、1.4molH2(g),浓度商
;若起始时乙容器中加入1.5molC(s)、1.2molH2O(g)、0.5molCO2(g)、1.4molH2(g),浓度商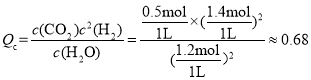 ,浓度商Qc<平衡常数K,平衡正向移动,则v正>v逆;
,浓度商Qc<平衡常数K,平衡正向移动,则v正>v逆;
(2)①随温度的升高CO转化率降低,这说明升高温度平衡向逆反应方向进行,则正反应是放热反应,因此ΔH2<0;
②a.升高温度平衡向逆反应方向进行,因此温度越高,该反应的平衡常数越小,a错误;
b.在恒容容器中,达平衡后再充入稀有气体,反应物浓度不变,CO的转化率不变,b错误。
c.正反应体积减小,则容器内气体压强不再变化时,反应达到最大限度,即达到平衡状态,c正确;
d.正反应体积减小,增大压强平衡向正反应方向进行,CO转化率增大,所以图中压强P1<P2,d正确;
答案选cd;
③0-3min内消耗氢气是4mol,生成甲醇是2mol,其浓度为0.2mol/L,则用甲醇表示的反应速率![]()
④200℃时,利用三等式可求出该反应的平衡常数,有:

所以200℃时,该反应的平衡常数![]() ;
;
向上述200℃达到平衡的恒容密闭容器中再加入2molCO、2molH2、2molCH3OH,此时CO、H2、CH3OH的浓度变为0.4mol·L-1、0.6mol·L-1、0.4mol·L-1;保持温度不变,此时浓度熵![]() ,小于平衡常数,则化学平衡正向移动。
,小于平衡常数,则化学平衡正向移动。

【题目】实验题
甲同学拟通过实验探究同主族元素性质的递变规律。其设计的实验方案如下,请你帮他填写完整,并做出评价。
实验室提供的试剂: NaBr溶液、NaI溶液、新制的氯水
(1)实验目的:
①写出下列实验报告中的实验现象和离子方程式
实验步骤 | 实验现象 | 实验结论及离子方程式 |
| 甲___________ 乙___________ | 离子方程式 甲___________ 乙___________ 结论:卤素单质的氧化性由强到弱的顺序为Cl2>Br2>I2 |
②【评价】甲同学设计的实验方案的合理性是___________(填序号)
A. 非常合理 B. 部分合理 C. 完全不合理
③【补充和完善】上一题②中若选A,则此项不用再作答,若选B或C,则完成实验还需要的试剂是___________。
(2)下表是元素周期表主族元素的一部分,短周期元素X的最高正化合价是+5,Y的单质可在空气中燃烧。
W | X | Y |
Z |
请回答下列问题:
①写出Z的原子结构示意图:__________________。
②探究同主族元素性质的一些共同规律,是学习化学的重要方法之一。在下表中列出对H2ZO3各种不同化学性质的推测,举例并写出相应的化学方程式(化学方程式中用Z表示即可) _____
编号 | 性质推测 | 化学方程式 |
示例 | 氧化性 | H2ZO3+4HI===Z↓+2I2+3H2O |
1 | ||
2 |
③由C、O和Y三种元素组成的化合物COY中,所有原子的最外层都满足8电子结构。写出该化合物的电子式:__________________。
【题目】25℃时,三种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka___(填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是___(填序号)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)用蒸馏水稀释0.1mol/L的醋酸,下列各式表示的数值随水量的增加而增大的是___(填序号)。
a.![]() b.
b.![]()
c. ![]() d.
d.![]()
(4)常温下,0.1mol/LNaHCO3溶液的pH大于8,则溶液c(H2CO3)___c(CO32-)(填“>、<或=”),原因是___。
(5)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中:
①![]() =___(填“精确数值”,下同)。
=___(填“精确数值”,下同)。
②c(CH3COO-)-c(Na+)=___mol/L。