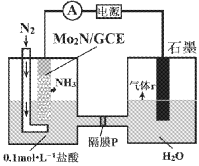
题目内容
【题目】25℃时,三种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka___(填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是___(填序号)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)用蒸馏水稀释0.1mol/L的醋酸,下列各式表示的数值随水量的增加而增大的是___(填序号)。
a.![]() b.
b.![]()
c. ![]() d.
d.![]()
(4)常温下,0.1mol/LNaHCO3溶液的pH大于8,则溶液c(H2CO3)___c(CO32-)(填“>、<或=”),原因是___。
(5)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中:
①![]() =___(填“精确数值”,下同)。
=___(填“精确数值”,下同)。
②c(CH3COO-)-c(Na+)=___mol/L。
【答案】增大 a>b>d>c b > HCO3-水解程度大于电离程度 18 9.9×10-7
【解析】
(1)弱电解质电离是吸热的,升高温度,会促进电离,电离平衡常数Ka增大;
(2)酸电离出H+能力越弱,那么其对应的酸根阴离子结合H+能力越强,从表中数据可以看出,HCO3-电离出H+能力最弱,则CO32-结合H+能力最强;最弱的为CH3COO-,ClO-大于HCO3-,所以四种离子结合质子能力由大到小的顺序是a>b>d>c;
(3)用蒸馏水稀释0.1mol/L的醋酸,促进醋酸的电离,但是溶液的酸性减弱;
a.上下同时乘以溶液的体积,有![]() ,加水稀释,醋酸的电离被促进,n(CH3COOH)减小,n(H+)增大,则
,加水稀释,醋酸的电离被促进,n(CH3COOH)减小,n(H+)增大,则![]() 减小,a不符合题意;
减小,a不符合题意;
b.上下同时乘以溶液的体积,有![]() ,加水稀释,醋酸的电离被促进,n(CH3COOH)减小,n(CH3COO-)增大,则
,加水稀释,醋酸的电离被促进,n(CH3COOH)减小,n(CH3COO-)增大,则![]() 增大,b符合题意;
增大,b符合题意;
c.在溶液中,Kw=c(H+)c(OH-),则![]() ,用水稀释醋酸,溶液的酸性减弱,c(OH-)增大,则
,用水稀释醋酸,溶液的酸性减弱,c(OH-)增大,则![]() 减小,c不符合题意;
减小,c不符合题意;
d.用水稀释醋酸,溶液的酸性减弱,c(OH-)增大,c(H+)减小,则![]() 减小,d不符合题意。
减小,d不符合题意。
答案选b;
(4)NaHCO3在溶液中电离出HCO3-,HCO3-即可以电离又可以水解,其电离和水解的方程式分别为HCO3-![]() H++CO32-,HCO3-+H2O
H++CO32-,HCO3-+H2O![]() H2CO3+OH-,从方程式可知,HCO3-电离使得溶液显酸性,水解使得溶液显碱性;现NaHCO3溶液显碱性,说明HCO3-的水解程度大于其电离程度,水解产生的H2CO3多余电离产生的CO32-,则c(H2CO3)>c(CO32-),原因是HCO3-水解程度大于电离程度;
H2CO3+OH-,从方程式可知,HCO3-电离使得溶液显酸性,水解使得溶液显碱性;现NaHCO3溶液显碱性,说明HCO3-的水解程度大于其电离程度,水解产生的H2CO3多余电离产生的CO32-,则c(H2CO3)>c(CO32-),原因是HCO3-水解程度大于电离程度;
(5)①醋酸的电离方程式为CH3COOH![]() CH3COO-+H+,其电离平衡常数
CH3COO-+H+,其电离平衡常数![]() ,则
,则![]() ,pH=6,c(H+)=10-6mol·L-1,K=1.8×10-5,带入数值
,pH=6,c(H+)=10-6mol·L-1,K=1.8×10-5,带入数值![]() ;
;
②在混合溶液中,根据电荷守恒,有c(H+)+c(Na+)=c(CH3COO-)+c(OH-),则c(CH3COO-)-c(Na+)=c(H+)-c(OH-),溶液pH=6,则c(H+)=10-6mol·L-1,c(OH-)=10-8mol·L-1,带入数据,得c(CH3COO-)-c(Na+)=10-6mol·L-1-10-8mol·L-1=9.9×10-7mol·L-1。

 阅读快车系列答案
阅读快车系列答案【题目】工业上,煤的气化和液化是高效、清洁、综合利用煤炭的重要途径。
(1)一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应:C(s)+2H2O(g)![]() CO2(g)+2H2(g) ΔH1>0,相关数据如下表:
CO2(g)+2H2(g) ΔH1>0,相关数据如下表:
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | |
C(s) | H2O(g) | H2(g) | |||
甲 | 2 | T1 | 3 | 4 | 3.2 |
乙 | 1 | T2 | 1.5 | 2 | 1.2 |
①T1___T2(填“>、<或=”)。
②T1时达到平衡后再加入1molH2O(g),达到新平衡后H2(g)的物质的量分数___(填“增大”“不变”或“减小”);T2时,若起始时乙容器中加入1.5molC(s)、1.2molH2O(g)、0.5molCO2(g)、1.4molH2(g),此时v正___v逆(填“>、<或=”)。
(2)煤液化时发生反应:CO(g)+2H2(g)![]() CH3OH(g)ΔH2,在10L恒容密闭容器中按物质的量之比1:2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时,n(H2)随时间的变化如下表所示:
CH3OH(g)ΔH2,在10L恒容密闭容器中按物质的量之比1:2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时,n(H2)随时间的变化如下表所示:

t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①ΔH2___0(填“>、<或=”)。
②下列说法正确的是___(填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强P1<P2
③0-3min内用CH3OH表示的反应速率v(CH3OH)=___mol/(L·min)(结果保留两位有效数值)。
④200℃时,该反应的平衡常数K=___。向上述200℃达到平衡的恒容密闭容器中再加入2molCO、2molH2、2molCH3OH,保持温度不变,则化学平衡___(填“正向”、“逆向”或“不”)移动。