题目内容
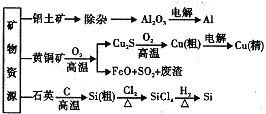
【题目】铋![]() 及其化合物广泛应用于电子、医药等领域。由辉铋矿(主要成分为
及其化合物广泛应用于电子、医药等领域。由辉铋矿(主要成分为![]() ,含杂质
,含杂质![]() 、
、![]() 等)制备
等)制备![]() 的工艺如下(已知水解能力:
的工艺如下(已知水解能力:![]() )
)
回答下列问题:
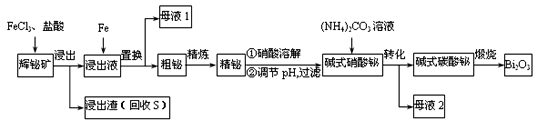
(1)为了提高浸出率,可采取的措施有_______________。(任写一条)
(2)“浸出”时![]() 与
与![]() 溶液反应的化学方程式为__________________________,盐酸的作用_________________________________________。
溶液反应的化学方程式为__________________________,盐酸的作用_________________________________________。
(3)“母液2”中主要溶质的化学式为________。
(4)“粗铋”中含有的主要杂质是Pb,可通过电解精炼除杂。电解质为熔融![]() 、KC1,电解后精铋留在粗铋电极下方电解槽底部。电解时,粗铋与电源_____(填“正”或“负”)极相连。阴极的电极反应为__________________________,铅元素的金属性比铋元素______。(填“强”“弱”或“不能确定”)。
、KC1,电解后精铋留在粗铋电极下方电解槽底部。电解时,粗铋与电源_____(填“正”或“负”)极相连。阴极的电极反应为__________________________,铅元素的金属性比铋元素______。(填“强”“弱”或“不能确定”)。
(5)碱式硝酸铋直接灼烧也能得到![]() ,上述工艺中转化为碱式碳酸铋再灼烧的优点是_________。
,上述工艺中转化为碱式碳酸铋再灼烧的优点是_________。
(6)常温下,向浓度均为![]() 的
的![]() 、
、![]() 的混合溶液中滴加
的混合溶液中滴加![]() 溶液,先生成__________沉淀,通过计算说明______________________________。[已知:Ksp(PbS) = 3.0×10-28,Ksp(Bi2S3) = 1.0×10-20]
溶液,先生成__________沉淀,通过计算说明______________________________。[已知:Ksp(PbS) = 3.0×10-28,Ksp(Bi2S3) = 1.0×10-20]
【答案】将矿石粉粹、搅拌、适当增大氯化铁溶液的浓度、适当升高温度等 Bi2S3+6FeCl3=2BiCl3+6FeCl2+3S 抑制Bi3+水解,提高Bi的产率 NH4NO3 正 Pb2++2e-=Pb 强 没有氮氧化物等污染性气体产生 PbS Pb2+开始沉淀时,c(S2-)=![]() =3.010-27mol/L;Ksp(Bi2S3)=0.12×c3(S2-)=1.0×10-20,则Bi3+开始沉淀的c(S2-)=10-6mol/L,所以PbS先沉淀。
=3.010-27mol/L;Ksp(Bi2S3)=0.12×c3(S2-)=1.0×10-20,则Bi3+开始沉淀的c(S2-)=10-6mol/L,所以PbS先沉淀。
【解析】
(1)为了提高浸出率,采取的措施可从增大接触面积、升高温度、增大浓度等方面考虑。
(2)“浸出”时![]() 与
与![]() 溶液反应,从产物有S考虑,反应为氧化还原反应,Fe3+应表现出氧化性,加入盐酸,其作用应从Bi3+水解分析。
溶液反应,从产物有S考虑,反应为氧化还原反应,Fe3+应表现出氧化性,加入盐酸,其作用应从Bi3+水解分析。
(3)碱式硝酸铋中加入碳酸铵,转化为碱式碳酸铋,由此可得出“母液2”中主要溶质。
(4)电解时,铅应失电子,粗铋与电源正极相连。从电解液考虑,阴极应为Pb2+得电子生成Pb,从而得出铅元素的金属性比与铋元素的关系。
(5)上述工艺中转化为碱式碳酸铋再灼烧的优点应从产物对环境的影响进行分析。
(6)利用两种物质的溶度积常数进行计算,求出所需S2-的最低浓度,通过比较确定先生成沉淀的物质。
(1)为了提高浸出率,可采取的措施有将矿石粉粹、搅拌、适当增大氯化铁溶液的浓度、适当升高温度等。答案为:将矿石粉粹、搅拌、适当增大氯化铁溶液的浓度、适当升高温度等;
(2)“浸出”时![]() 与
与![]() 溶液反应,生成Bi3+、Fe2+和S,化学方程式为Bi2S3+6FeCl3=2BiCl3+6FeCl2+3S,盐酸的作用抑制Bi3+水解,提高Bi的产率。答案为:Bi2S3+6FeCl3=2BiCl3+6FeCl2+3S;抑制Bi3+水解,提高Bi的产率;
溶液反应,生成Bi3+、Fe2+和S,化学方程式为Bi2S3+6FeCl3=2BiCl3+6FeCl2+3S,盐酸的作用抑制Bi3+水解,提高Bi的产率。答案为:Bi2S3+6FeCl3=2BiCl3+6FeCl2+3S;抑制Bi3+水解,提高Bi的产率;
(3)“母液2”中主要溶质应为NO3-与NH4+结合成的物质,其化学式为NH4NO3。答案为:NH4NO3;
(4)电解后精铋留在粗铋电极下方电解槽底部,则Pb应转化为离子进入溶液。从而得出电解时,粗铋与电源正极相连。阴极的电极反应为Pb2++2e-=Pb,铅元素先失电子,则其金属性比铋元素强。答案为:正;Pb2++2e-=Pb;强;
(5)碱式硝酸铋直接灼烧也能得到![]() ,上述工艺中转化为碱式碳酸铋再灼烧的优点是没有氮氧化物等污染性气体产生。答案为:没有氮氧化物等污染性气体产生;
,上述工艺中转化为碱式碳酸铋再灼烧的优点是没有氮氧化物等污染性气体产生。答案为:没有氮氧化物等污染性气体产生;
(6)Pb2+开始沉淀时,c(S2-)=![]() =3.010-27mol/L,Ksp(Bi2S3) =0.12×c3(S2-)=1.0×10-20,则Bi3+开始沉淀的c(S2-)=10-6mol/L,所以PbS先沉淀。答案为:PbS;Pb2+开始沉淀时,c(S2-)=
=3.010-27mol/L,Ksp(Bi2S3) =0.12×c3(S2-)=1.0×10-20,则Bi3+开始沉淀的c(S2-)=10-6mol/L,所以PbS先沉淀。答案为:PbS;Pb2+开始沉淀时,c(S2-)=![]() =3.010-27mol/L,Ksp(Bi2S3) =0.12×c3(S2-)=1.0×10-20,则Bi3+开始沉淀的c(S2-)=10-6mol/L,所以PbS先沉淀。
=3.010-27mol/L,Ksp(Bi2S3) =0.12×c3(S2-)=1.0×10-20,则Bi3+开始沉淀的c(S2-)=10-6mol/L,所以PbS先沉淀。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案【题目】工业上,煤的气化和液化是高效、清洁、综合利用煤炭的重要途径。
(1)一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应:C(s)+2H2O(g)![]() CO2(g)+2H2(g) ΔH1>0,相关数据如下表:
CO2(g)+2H2(g) ΔH1>0,相关数据如下表:
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | |
C(s) | H2O(g) | H2(g) | |||
甲 | 2 | T1 | 3 | 4 | 3.2 |
乙 | 1 | T2 | 1.5 | 2 | 1.2 |
①T1___T2(填“>、<或=”)。
②T1时达到平衡后再加入1molH2O(g),达到新平衡后H2(g)的物质的量分数___(填“增大”“不变”或“减小”);T2时,若起始时乙容器中加入1.5molC(s)、1.2molH2O(g)、0.5molCO2(g)、1.4molH2(g),此时v正___v逆(填“>、<或=”)。
(2)煤液化时发生反应:CO(g)+2H2(g)![]() CH3OH(g)ΔH2,在10L恒容密闭容器中按物质的量之比1:2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时,n(H2)随时间的变化如下表所示:
CH3OH(g)ΔH2,在10L恒容密闭容器中按物质的量之比1:2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时,n(H2)随时间的变化如下表所示:

t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①ΔH2___0(填“>、<或=”)。
②下列说法正确的是___(填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强P1<P2
③0-3min内用CH3OH表示的反应速率v(CH3OH)=___mol/(L·min)(结果保留两位有效数值)。
④200℃时,该反应的平衡常数K=___。向上述200℃达到平衡的恒容密闭容器中再加入2molCO、2molH2、2molCH3OH,保持温度不变,则化学平衡___(填“正向”、“逆向”或“不”)移动。